橘小实蝇和番石榴实蝇对杧果挥发物的电生理反应
Electrophysiological Responses of Bactrocera dorsalis and Bactrocera correcta to Volatiles from Mango Fruits
-
乳油木(Vitellaria paradoxa C.F.Gaertn.)是山榄科牛油果属植物,原产于撒哈拉以南的热带稀树草原地带。在N15°以南至赤道地区,包括加纳、尼日利亚、达荷美、多哥、几内亚、马里、塞内加尔、乌干达和苏丹等国都有自然分布,其中以加纳北部最多[1]。在非洲,乳油木的脂肪物质被广泛使用,从肥皂到食品加工[2],尤其是在化妆品行业应用广泛。乳木果油可以添加到口红、唇彩和防晒霜等化妆品中,具有抗衰老、保湿和再生等功能[3]。研究表明:乳油木叶子有机质含量极高,可以加工成饲料喂养禽类[4];其果肉中含有蛋白质、碳水化合物、矿物质和纤维等对人体健康有益的成分,可以制作成蛋糕,也可以替代巧克力供人们食用,对人体健康有很大好处[5]。在布基法索和加纳地区,乳油木是仅次于可可和咖啡的第三大经济作物[6-7]。中国自20世纪60年代将乳油木引入云南元江种植,其原产地非洲加纳为沙漠型稀树草原,又称萨王纳群落,引种地云南省元江县属河谷型萨王纳群落,两地区气候特性存在一定差异[8],植物引种随着环境改变,其物候也会发生变化。
物候学是研究自然界中植物(包括农作物)、动物和环境条件(气候、水文和土壤条件)的周期变化间相互关系的科学[9],它对于认识自然季节现象变化规律与物种生物钟规律以及服务于农业生产管理具有重要意义。生物学家非常关注物候模式如何影响物种繁殖,而植物物候学研究提供了关于植物和植物群落功能节律的信息及其物候模式,各种物候事件的时间可以反映生物和或非生物的环境条件[10-11],因为物候是物种生命周期中一年四季的变化韵律,与温度、昼夜温差、日照长短、土壤特性和降雨等多个因素有关[12-14],温度变化会间接影响植物对于水分及养分的运输和吸收[15-16],从而对物候产生作用,使得植物的展叶、开花和结果的时间及特性都会有所差异。
物候过程由多个物候事件组成,从营养生长到生殖生长,每个阶段都有其特定的特征及重要性,并反映了其生态适应性,如开花的季节性和持续时间影响传粉者的效率,从而影响果实的大小和产量。国外学者已对乳油木物候学做过一些研究,包括乳油木物候事件结束时间及规律、开花特性(花期、丰度和能力)与不同类型种植地的关系、开花时间与结果数量的关系等[17-18]。国内亦对乳油木的油脂组成、油脂提取工艺和种植现状等有一定的研究[19-22],但目前中国对引种种植乳油木的物候特征研究仍为空白,缺乏系统的监测记录,直接影响到乳油木种植产业。本研究选择元江种苗站乳油木种植基地的100株个体为观察对象,系统详细地记录了乳油木年周期的物候过程(展叶、开花与结实的物候),最后利用观察得到的物候数据进行统计分析,并与原产地对比,探究乳油木在云南干热河谷的物候特征,为其产业化种植与丰产栽培管理提供科学依据。
1. 材料与方法
1.1 研究区概况
基于元江干热河谷地区脆弱的生态环境,为改造和绿化元江两岸荒山,于1964年7月从西非加纳地区引种乳油木栽培到元江,目前仅在云南省元江县成片种植,长势较好[23]。元江县现存乳油木800余株,树龄约56年,引种8年后开始开花结实,15年后进入盛产期,单株产量几十公斤到上百公斤不等,引种取得阶段性成果。
研究地位于云南省玉溪市元江县种苗站(N23.60°,E101.97°,海拔430 m),地处元江县坝区,气候属典型的干热河谷气候,年平均气温23.8 ℃,最热月(6月)平均温度28.8 ℃,最冷月(1月)平均温度16.8 ℃,年积温达8700 ℃[24]。全年盛行东南风,每年大风(≥8级)的时间平均为14.3 d[25]。该地区的天然植被为河谷型稀树草原萨王纳群落,以草丛为背景构成大片的草地植被,其中散生稀疏的乔木和灌木,即群落外貌表现为“稀树—灌木—草丛”状[26],多种植热带性或者热起源的耐干旱树种[24],如杧果(Mangifera indica L.)和牛角瓜(Calotropis gigantea L.)等,或乳油木与杧果以及一些其他乔灌木套作。研究样地土壤多为以多沙页岩、石灰岩和砾岩等作为土壤基质的燥红壤,呈弱酸性,保水性差,土壤贫瘠[22,27]。
1.2 研究方法
1.2.1 物候观测方法
本研究的物候观测采用传统人工观测法,时间间隔为1周,利用双筒望远镜(10 mm×8 mm)及记录表进行观测记录。经调查发现:元江种苗站种植基地现存乳油木共844株,面积约8.8 hm2。研究地海拔451~509 m,将海拔和坡度等因素导入ArcGIS软件进行叠加从而随机取20个样地(图1),每个样地中选取5株树,共100株树作为物候试验的观察对象。观察时间由2019年3月5日—10月30日,共分为包括叶、花和果实物候观测项的13个阶段,即:叶变色期(叶片由深绿色逐渐变为黄褐色)、叶落期(叶片变为黄褐色后脱落)、叶芽期(叶芽出现至展开之前)、展叶期(叶芽舒展为叶片,颜色为翠绿色)、叶成熟期(叶片颜色由翠绿色变为深绿色)、现蕾期(枝条顶部出现苞状小花蕾)、花蕾开放期(簇生于枝条顶部的花蕾中,有部分花蕾开放)、盛花期(枝条顶部50%花蕾开放)、落花期(盛开的花朵掉落)、现果期(顶部具针状物小果的出现)、果粉覆盖期(黄褐色果粉覆盖果实表面)、果变色期(果粉褪去,果实为翠绿色)和果实成熟期(果实由翠绿色变为亮绿色)。
1.2.2 果实成熟期的性状指标的测量方法
采用田间生物学调查和室内测量相结合的方法。由于树高不等(5.3~13 m),故利用直接攀爬及借助长杆(带网兜及切割刀片)取果。从每周定点进行物候观测的100株树中随机选取30株结实植株作为测量对象,从2019年7月10日—9月25日(果实发育成熟期),共计12周,每周从每株树上随机挑取3个果实,共计90个果实带回实验室进行试验。主要观察的表观特征有外果皮颜色、果壳颜色和种仁颜色,测量指标包括单果鲜质量(g)、单个种仁鲜质量(g)、果实纵径和横径(cm)以及种子纵径和横径(cm),取平均值。颜色直接用肉眼观察,用分析天平称量果实质量,用电子游标卡尺测量纵径和横径,直至这些特性基本稳定,则判定果实成熟。
1.3 数据处理
1.3.1 物候学指标计算
以13个物候阶段的起始和结束时间来计算弗涅尔指数FI (Fournier index),并以盛花期持续时间作为同步性 (synchrony)指数数据分析的基础。其中,FI主要用来表征植物物候活动的强度,从而得出其物候特征[28];synchrony值则用来比较植株开花时间的重叠程度,当synchrony值为0时,代表该植株与所在样地中其他植株的花期没有任何重叠,而当synchrony值为1时,则表示完全重叠[29]。
(1)物候观察数据的转换
在物候记录表记录“0”代表该物候阶段未出现或者已经结束,“1”代表存在该物候阶段。整理物候数据,得到每棵植株在整个物候期的数据。先把物候期数据由日期型转化为数值型,物候数据的处理是换算为 Julian day (儒略日) 的形式:1月1日为第1天,1月2日为第2天……然后依次往后推,直到12月31日为第365天[30]。
(2) FI的计算
$ {\rm{FI}}=\sum\nolimits_{i=1}^{n}{x}_{i}/(n\times c) $


(1) 式中,n为每个样地点观测的个体数量;xi为个体i的半定量量表值,如某个样地点的1株植株在开花物候4个阶段中的2个阶段出现,则半定量量表值分别为2和2,即为物候期分成的阶段数c/出现物候阶段的个数;c为该物候期分成的阶段数,如本研究中开花物候分为4个阶段,则c=4。本研究中,先根据所得物候数据计算xi,将xi代入式(1),计算出每个样地点每株树在记录周的FI,进行平均值计算得每个样本点在记录周的FI。为了表征整个种植地的物候特征,需再将20个样地的数据平均,得到最终的平均FI。
(3) S (synchrony)的计算
$ {\rm{S}}=\frac{1}{(n-1)}\times \sum \frac{a_{ij}}{b_{ij}} $


(2) 式中,n为观测对象的数量;aij表示i个体和j个体同时开花的天数;bij表示i个体和j个体最先开花到最后开花结束之间的天数。利用物候数据中每株植株的盛花期持续时间,进行样地中两两植株之间的aij/bij计算,得到Sumij,代入式(2)可得每株植株在样地中的synchrony值。样地间synchrony值计算同上。
1.3.2 果实成熟特性
将每周的测量数据进行汇总,分别得出每株树每周测量指标的平均值,测量指标包括:单果鲜质量(g)、单个种仁鲜质量(g)、果实纵径和横径(cm)、种子纵径和横径(cm),共计12周。利用SPSS 24软件进行描述统计分析,得到每项指标每周的最小值、最大值、平均值、中位值、方差和标准差。最后将每项指标每周的平均值和标准差放入R3.6.1中做线性回归分析。
2. 结果与分析
2.1 乳油木叶片物候期特征
由图2可知:叶变色阶段,叶片由深绿色逐渐变为黄色,叶柄不断失水干枯,直至自然掉落。乳油木落叶期持续时间较长,从当年9月开始至次年6月都有落叶现象;叶落之后1~4周,叶芽开始出现,叶芽顶部为浅粉色,不断伸长,慢慢展开,形成簇生于枝条顶部的展开叶片,叶片由嫩绿色逐渐转变为深绿色,形状为长圆形。可能由于树木的健康状况或种植位置的不同,导致该过程需要的时间有所差异,一般为4~8周。
乳油木的叶芽期和展叶期持续时间较长(图3),观察期间每周都有新的叶片展开,而叶片变色期和叶落期只出现在3月—6月初(旱季末和雨季初)。叶芽开放约7周后,叶片开始成熟。现叶芽期、展叶期、叶片成熟期、叶片变色期和叶落期的持续时间分别为175、210、168、91和98 d。叶落期、现叶芽期和展叶期都有较为明显的高峰期,分别出现在第86~100天(3月26—4月9日)、第114~142天(4月23—5月21)和第135~170天(5月14日—6月18日),其中现叶芽期和展叶期分别具有2个高峰。
2.2 乳油木开花物候期特征及开花同步性
2.2.1 开花物候期特征
由图4可知:元江的乳油木花期普遍开始于3月,持续到当年8月基本结束,再往后开花的个别植株出现开花而不育现象。乳油木的花蕾与叶芽生长模式类似,也是簇生于枝条顶部,初始花蕾颜色为暗红色,随着时间的推移,热量不断积累和营养物质摄入,花梗伸长,花蕾开始膨大,颜色变为翠绿色,直至开放,时间为2~4周;随着花蕾的开放,花期进入盛花阶段,花冠为卵形多裂,花瓣为白色,全缘。随机选择不同植株的共30朵花进行观察,发现花开至花落的时间为5~14 d,平均时间为10 d。
由图5可知:现花蕾期、花蕾开放期、盛花期和花落期分别为182、147、147和154 d,其高峰分别为第100~121天(4月9日—4月30日)、第114~135天(4月23日—5月14日)、第121~135天(4月30日—5月14日)和第128~163天(5月7日—6月11日)。现花蕾期、花蕾开放期和盛花期3个物候阶段仅出现在观察期前半段,而花落则在第198~212天(7月16日—7月30日)之间有短暂的结束,直到8月底才完全结束。
2.2.2 开花同步性
在100株物候试验观察对象中,除去24棵当年不开花的树,可得76个同步性指数(synchrony)值,平均值为0.582。由图6可知:少部分植株的同步值很低,synchrony小于0.1的植株数量为10;大部分植株的同步值较高,synchrony值大于等于0.5的植株数量为55,占约76.4%;大于平均值的植株数量为42,约占55.3%;synchrony值等于1的有12株。可见,样本点中的各个植株之间在花期时间上有很大的重叠,开花同步性较高。由表1可见:88.4% (168/190,共190种组合,有168种组合之间的synchrony值大于0)的样点盛花期有重叠,其中完全重叠即synchrony值为1的组合情况约为44% (88/190),各样点间盛花期存在高度重叠情况,同步性较高。
表 1 20个样点之间盛花期同步性矩阵表Table 1. The synchronization matrix between 20 sites in flower bloom during the monitoring样地编号
No. of sampling sites1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 1 0.05 1 1 0 0.05 1 1 1 1 1 1 1 1 0.05 0.05 0.05 1 1 0.05 2 0.05 0.05 0 0.05 0.05 0.05 0.05 0.05 0.05 0.33 0.05 0.33 1 1 1 0.05 0.05 0 3 1 0 0.05 1 1 1 1 1 1 1 1 0.05 0.05 0.05 1 1 0.05 4 0 0.05 1 1 1 1 1 1 1 1 0.05 0.05 0.05 1 1 0.05 5 0.05 0 0 0 0 0 0 0 0 0 0 0 0 0 0.05 6 0.05 0.05 0.05 0.05 0.05 0.33 0.05 0.33 1 1 1 0.05 0.05 0 7 1 1 1 1 1 1 1 0.05 0.05 0.05 1 1 0.05 8 1 1 1 1 1 1 0.05 0.05 0.05 1 1 0.05 9 1 1 1 1 1 0.05 0.05 0.05 1 1 0.05 10 1 1 1 1 0.05 0.05 0.05 1 1 0.05 11 1 1 1 0.05 0.05 0.05 1 1 0.05 12 0.33 1 1 0.05 0.05 1 1 0.05 13 0.33 0.05 0.05 0.05 1 1 1 14 1 0.33 0.05 1 1 0.05 15 1 1 0.05 0.05 0 16 1 0.05 0.05 0 17 0.05 0.05 0 18 1 0.05 19 0.05 20 2.3 乳油木结实物候期及果实性状
由图7可知:大部分植株在花落2周后开始形成果实,小果顶部有针状物出现,后期脱落。果实不断膨大,颜色由浅绿色被绒毛变为表面覆盖黄褐色果粉,之后果粉又不断褪去,直至果实完全显现出翠绿色。果实从发育到成熟过程(图8)的表观特征为果实果皮表面由翠绿色变为亮绿色,果壳颜色变化为由乳白色到浅黄色,再到黄褐色,最后变为褐色,果仁的颜色为乳白和浅粉相间。
由图9可知:乳油木果实的纵径、横径和质量不断增大,到第9~11周附近趋于稳定。回归分析发现:鲜果质量的增长速率最快,而果实横径的增长速率最慢,无论是从果实还是种子看,果实的纵向生长速率大于横向生长速率。成熟果实的平均单果鲜质量为22.04~24.56 g,果实横径为3.43~3.59 cm,果实纵径为3.86~4.02 cm,单果的平均鲜种子质量为8.13~8.93 g,种子横径为2.32~2.44 cm,果实纵径为2.92~3.05 cm。
由图10可知:果期物候的各个阶段都有较为明显的高峰期,从现果期、覆盖果粉期、果实变色期到果实成熟期,每个阶段的高峰期相应推后,其中现果期持续时间为147 d,高峰期约为第149~170天(5月28日—6月18日);果实发育约3~4周后开始被果粉覆盖,覆盖果粉期持续时间为140 d,高峰期约为第184~205天(7月2日—7月23);果实变色期的持续时间为40 d,高峰时间段约为第225~254天(8月12日—9月10日),果实从果粉覆盖期到开始褪去果粉、显现出亮绿色需要约6周。
3. 讨论
物候是物种重要的生物学特征。同种植物在不同生长环境的物候学特征也可能发生改变。通过本研究可知:非洲撒哈拉沙漠以南乌干达地区及喀麦隆等地原生境生长的乳油木物候[17, 31]与元江干热河谷引种的乳油木物候在叶片展叶、开花与结实物候期有相似之处,如元江种植的乳油木的叶片形状以及簇生方式都与在非洲地区相似。乳油木在河谷型萨王纳气候类型下的生物学特征并未发生明显的改变,这可能与该物种对干热地区广泛的适应性与遗传特性等有关。引种驯化与繁殖生物学证明了乳油木在西南干热河谷引种成功[32]。非洲乳油木在元江干热河谷能正常生长发育与传种接代,每一单株不仅有生物学产量,而且有很好的经济性状,并可完成从种子到种子的生命周期,是中国非洲木本种质资源引种较为成功的一个案例。
不同物种或同一物种由于立地条件不同导致物候特征差异[15, 33-34]。元江引种的乳油木与原产地非洲[17, 31]相比,其生物学特征及物候事件持续时间依旧与原生境基本一致,如:在叶片物候期中,元江的叶蕾开放期为每年3—9月,而非洲地区叶蕾开放期则为当年11月—次年4月,持续时间均为6~7个月;开花物候期中,元江和非洲地区的持续时间为5~6个月,两地的果实从发育到成熟期需要的时间均约为6个月[17],说明植株内在物质的积累机制可能没有变化。物种物候事件与种植地的立地气候条件有关。相关研究表明:中国西南干热河谷气候与典型的萨王纳气候相比,年平均气温偏低(19.2~23.8 ℃),温度的季节性变化大,并且在旱季前期有相对明显的低温季节,这使得元江干热河谷地区大部分木本植物的开花物候期集中在旱季末期和雨季初期,而结实物候期集中在雨季末期延续到旱季初期[8]。本研究中乳油木的物候期基本符合这种物候模式,表现出了对干热河谷较强的生态适应性。
物种开花物候通常存在2种极端现象:一种是植株个体基本上每天或每周都能大量开花,称为集中开花模式;而另一种则表现为基本上每天或几周都只能少量开花,称为持续开花模式[17, 34]。从开花期来看,乳油木属于前者,开花物候存在明显的高峰期,并且无论是从个体植株上(synchrony值大于等于0.5的植株占比为76.4%)还是群体水平上(88.4%样本点的花期存在重叠),都具有较高的开花同步性,即多数植株集中在某一段时间开花。乳油木的主要传粉方式为昆虫传粉[35],集中开花和较高的开花同步性是乳油木为了适应干热河谷风大的气候特点,这种适应能够提高传粉效率和坐果率,从而使果实产量增加,这种对环境的适应性在很多植物上都有体现[36-37]。
物种物候受遗传因子与环境因子(土壤特性、温度和降水等)的影响较大[15, 38],不同的生长环境会导致同种植株的物候特征有差异。2018年与2019年元江县乳油木的果实成熟期不同,2019年更晚,平均气温、降水和有效积温等都可能是导致该现象发生的原因,这需要多年的物候数据积累才能进行更深层次的探讨,而本研究则揭示了乳油木整个物候期的物候特征以及在开花期的同步性,为后期深入的物候学研究奠定了基础。在乳油木物候学初步研究基础上,我们也对乳油木引种驯化、推广种植与栽培管理提出以下建议。
(1)以元江种苗站乳油木种植基地为基础,建立西南干热河谷乳油木物候长期观察定位站,把手工记录观察变为长期自动观察,进一步揭示物候与气候因子的变化规律。
(2)加强乳油木种植园的科学管理,针对其花叶同期或者先花后叶的生长习性,设计园艺栽培试验,通过调节水肥与疏花试验,研究乳油木营养生长与生殖生长规律,为大面积产业化种植、提高产量、评价经济性状与经济效益积累科学依据。
(3)在8—10月果实成熟期,可选择优良母株与健康果实,开展良种繁育,建立乳油木育苗基地;结合退耕还林与植树造林,推广种植乳油木。
(4)进一步从原产地引种乳油木种质资源,扩充遗传多样性。优先选择乳油木果实果肉肥厚和种仁大的优良种质资源,为西南干热河谷生态修复与生态产业发展助力。
致谢:感谢云南省玉溪市元江县林木种苗工作站为本研究提供的乳油木相关信息与野外调查后勤保障。
-
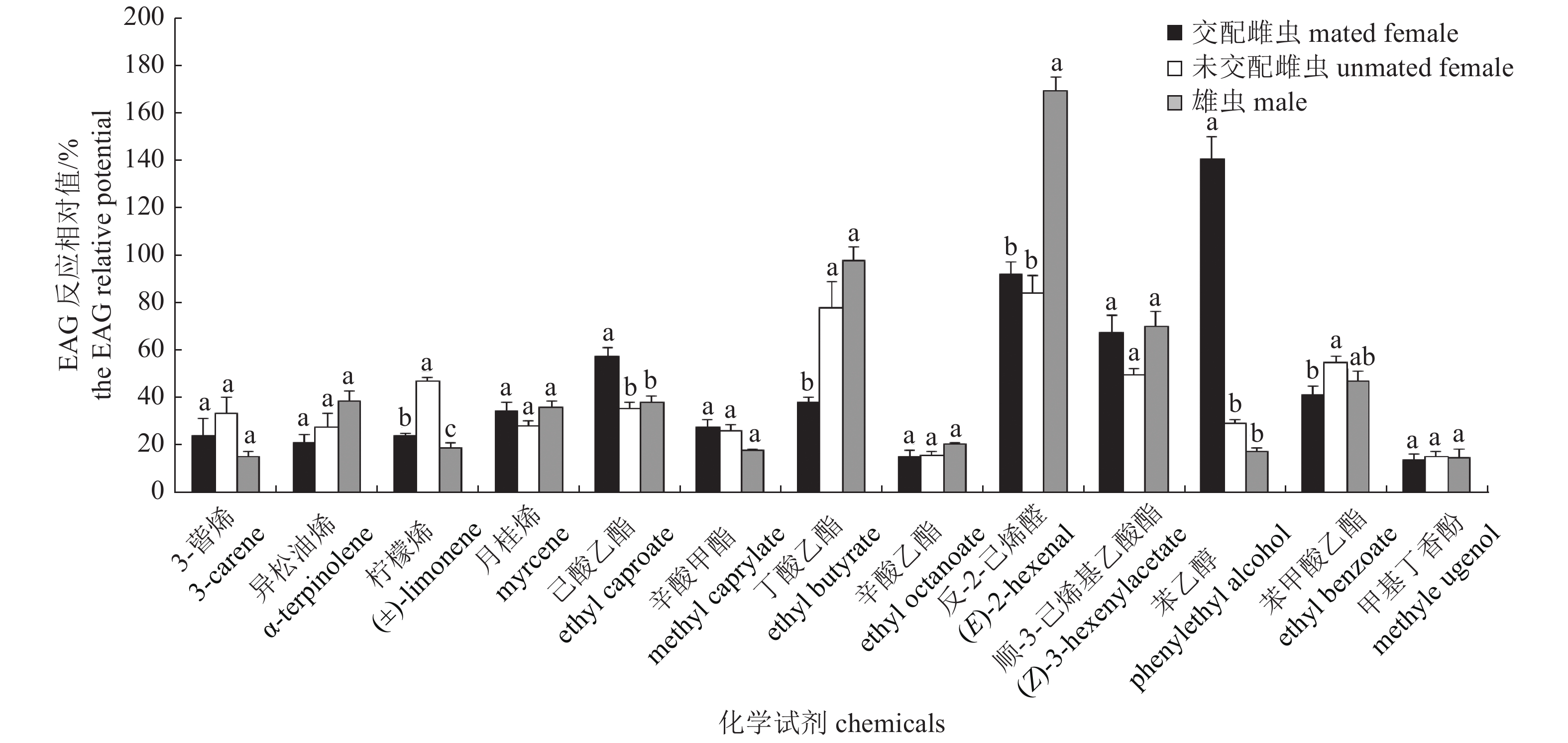
图 1 橘小实蝇雄虫、交配和未交配雌虫对杧果挥发物的EAG反应
注:不同小写字母表示雄虫、交配和未交配雌虫对不同化合物的EAG反应相对值经Turkey检验差异显著(P<0.05);下同。
Figure 1. EAG response of male, mated and unmated female of Bactrocera dorsalis to volatiles from mango fruits
Note: The different lowercase showed that there exist significant difference among the EAG relative potentials of male, mated and unmated female to different compounds by Tukey’s test (P<0.05); the same as below
表 1 13种标准样品的纯度及来源
Table 1 Purity and source of 13 standard chemicals
化合物compounds 纯度purity 公司company 产地origin 顺-3-己烯基乙酸酯(Z)-3-hexenyl acetate >97.0% TCI 日本Japan 反-2-己烯醛(E)-2-hexenal 99.0% ACRÖS 美国the U.S.A 辛酸甲酯methyl caprylate 99.0% TCI 日本Japan 己酸乙酯ethyl caproate 99.0% ACRÖS 美国the U.S.A 丁酸乙酯ethyl butyrate >98.0% TCI 日本Japan 辛酸乙酯ethyl caprylate >99.0% Alorich 美国the U.S.A 甲基丁香酚methyl eugenol 98.0% J&K 日本Japan 苯甲酸乙酯ethyl benzoate 99.0% J&K 日本Japan 苯乙醇phenylethyl alcohol 99.0% Fluka 美国the U.S.A 3-蒈烯3-carene 90.0% J&K 日本Japan 异松油烯α-terpinolene 97.0% ACRÖS 美国the U.S.A 月桂烯myrcene 90.0% J&K 日本Japan 柠檬烯(±)-limonene 95.0% J&K 日本Japan 表 2 橘小实蝇、番石榴实蝇对杧果同一种挥发物的EAG反应比较(mean±SE)
Table 2 Comparison of EAG response of B. dorsalis and B. correcta to volatiles from mango fruits
化合物compounds 虫名insect EAG反应相对值/% the EAG relative potential 交配雌虫mated female 未交配雌虫unmated female 雄虫male 3-蒈烯3-carene 橘小实蝇B. dorsalis 9.68±0.41 11.55±1.48 9.49±1.72 番石榴实蝇B. correcta 16.62±7.51 a 33.88±6.64 a 15.50±1.77 a 异松油烯α-terpinolene 橘小实蝇B. dorsalis 15.76±1.72 10.59±1.30 19.08±2.81 番石榴实蝇B. correcta 21.18±3.91 27.94±5.88 a 38.99±4.31 a 柠檬烯(±)-limonene 橘小实蝇B. dorsalis 11.45±0.76 30.37±3.76 24.50±2.62 番石榴实蝇B. correcta 24.31±0.87 A 47.45±1.50 A 18.95±2.01 月桂烯myrcene 橘小实蝇B. dorsalis 24.24±0.23 74.42±0.23 A 42.64±3.90 番石榴实蝇B. correcta 34.70±3.79 a 28.28±2.20 36.62±2.36 己酸乙酯ethyl caproate 橘小实蝇B. dorsalis 41.08±1.86 39.91±0.55 a 40.40±2.95 番石榴实蝇B. correcta 57.69±3.82 a 35.78±2.72 38.36±2.79 辛酸甲酯methyl caprylate 橘小实蝇B. dorsalis 11.62±0.51 20.78±0.52 21.33±1.11 番石榴实蝇B. correcta 27.82±3.14 A 26.18±3.10 18.11±0.50 丁酸乙酯ethyl butyrate 橘小实蝇B. dorsalis 73.12±3.49 A 74.14±9.43 92.12±5.60 番石榴实蝇B. correcta 38.37±2.29 78.53±10.61 98.06±5.67 辛酸乙酯ethyl caprylate 橘小实蝇B. dorsalis 23.93±2.09 A 17.00±1.87 15.01±3.42 番石榴实蝇B. correcta 15.59±2.27 15.98±1.36 20.63±0.78 反-2-己烯醛(E)-2-hexenal 橘小实蝇B. dorsalis 143.20±6.92 a 127.12±8.15 A 120.41±6.91 番石榴实蝇B. correcta 92.61±4.97 84.83±7.16 170.26±5.55 A 顺-3-己烯基乙酸酯(Z)-3-hexenyl acetate 橘小实蝇B. dorsalis 72.94±6.31 57.54±3.30 a 31.15±1.66 番石榴实蝇B. correcta 68.03±7.12 49.92±2.45 70.41±6.20 A 苯乙醇phenylethyl alcohol 橘小实蝇B. dorsalis 8.13±0.78 10.36±0.84 11.45±2.79 番石榴实蝇B. correcta 141.24±9.23 A 29.45±1.55 A 17.68±1.25 a 苯甲酸乙酯ethyl benzoate 橘小实蝇B. dorsalis 40.48±3.92 60.10±3.83 58.08±9.51 番石榴实蝇B. correcta 41.87±3.59 55.24±2.41 47.65±3.80 甲基丁香酚methyl eugenol 橘小实蝇B. dorsalis 9.56±1.73 11.15±1.33 15.07±0.26 番石榴实蝇B. correcta 13.62±2.71 a 15.64±1.87 14.77±4.04 注:“a”表示表示橘小实蝇、番石榴实蝇对同一化合物的EAG反应相对值经t-检验差异显著(P<0.05),“A”表示橘小实蝇、番石榴实蝇对同一化合物的EAG反应相对值经t-检验差异极显著(P<0.01)。
Note: “a” indicates that there exist significant difference among the EAG relative potentials of B. dorsalisand B. correctato same compound by t-test (P<0.05), “A” indicates that there exist significant difference among the EAG relative potentials ofB. dorsalisand B. correctato same compound by t-test (P<0.01). -
[1] ANSARI M S, HASAN F, AHMAD N. Threats to fruit and vegetable crops: fruit flies (Tephritidae)-ecology, behaviour, and management[J]. Journal of Crop Science and Biotechnology, 2012, 15(3): 169. DOI: 10.1007/s12892-011-0091-6.
[2] 马兴莉, 刘海军, 李志红, 等. 我国口岸截获东盟实蝇疫情分析[J]. 植物检疫, 2012, 26(5): 83 [3] 李伟丰, 杨朗, 唐侃, 等. 中国橘小实蝇种群的微卫星多态性分析[J]. 昆虫学报, 2007, 50(12): 1255. DOI: 10.3321/j.issn:0454-6296.2007.12.009 [4] STEPHENS A E A, KRITICOS D J, LERICHE A. The current and future potential geographical distribution of the oriental fruit fly, Bactrocera dorsalis (Diptera: Tephritidae)[J]. Bulletin of Entomological Research, 2007, 97(4): 369. DOI: 10.1017/S0007485307005044.
[5] WAN F H, GUO J Y, ZHANG F. Research on biological invasions in China[M]. Beijing: Science Press, 2009.
[6] 张彬, 刘映红, 赵岚岚, 等. 橘小实蝇研究进展[J]. 中国农学通报, 2008, 24(11): 391 [7] LIU X F, JIN Y, YE H. Recent spread and climatic ecological niche of the invasive guava fruit fly, Bactrocera correcta, in mainland China[J]. Journal of Pest Science, 2013, 86(3): 449. DOI: 10.1007/s10340-013-0488-8.
[8] 吕文刚, 邓裕亮, 李志红, 等. 番石榴果实蝇在我国的潜在地理分布[J]. 植物保护学报, 2010(6): 529. DOI: 10.13802/j.cnki.zwbhxb.2010.06.003 [9] 刘慧, 侯柏华, 张灿, 等. 橘小实蝇和番石榴实蝇对6种寄主果实的产卵选择适应性[J]. 生态学报, 2014, 34(9): 2274. DOI: 10.5846/stxb201306101613 [10] 刘晓飞, 陈强, 叶辉. 橘小实蝇与番石榴实蝇幼虫的种间竞争研究[J]. 环境昆虫学报, 2014, 36(1): 34. DOI: 10.3969/i.issn.1674-0858.2014.01.06 [11] STEINER L F. Methyl eugenol as an attractant for oriental fruit fly[J]. Journal of Economic Entomology, 1952, 45(2): 241. DOI: 10.1093/jee/45.2.241.
[12] JR WEEMS H W, FASULO T R. Guava fruit fly, Bactrocera correcta (Bezzi)(Insecta: Diptera: Tephritidae)[R/OL]//EENY-200, 2002. [2017-09-07]. http://edis.ifas.ufl.edu/in357.
[13] 王延年, 郑忠庆, 周永生, 等. 昆虫人工饲料手册[M]. 上海: 上海科学技术出版社, 1984. [14] 袁盛勇, 孔琼, 肖春, 等. 橘小实蝇成虫人工饲料的筛选[J]. 华中农业大学学报, 2006, 25(4): 371. DOI: 10.3321/j.issn:1000-2421.2006.04.007 [15] DAS P D, RAINA R, PRASAD A R, et al. Electroantennogram responses of the potato tuber moth, Phthorimaea operculella (Lepidoptera; Gelichiidae) to plant volatiles[J]. Journal of Biosciences, 2007, 32(2): 340. DOI: 10.1007/s12038-007-0033-0.
[16] 付晓伟, 郭线茹, 罗梅浩, 等. 烟夜蛾和棉铃虫对高浓度烟草挥发物的电生理和行为反应[J]. 昆虫学报, 2008, 51(9): 904. DOI: 10.3321/j.issn:0454-6296.2008.09.002 [17] VISSER J H. Host odor perception in phytophagous insects[J]. Annual Review of Entomology, 1986, 31(1): 121. DOI: 10.1146/annurev.en.31.010186.001005.
[18] 田厚军, 陈艺欣, 黄玉清. 昆虫触角电位技术的研究进展[J]. 福建农业学报, 2011, 26(5): 907. DOI: 10.3969/j.issn.1008-0384.2011.05.045 [19] LIGHT D M, JANG E B. Electroantennogram responses of the oriental fruit fly, Dacus dorsalis, to a spectrum of alcohol and aldehyde plant volatiles[J]. Entomologia Experimentalis et Applicata, 1987, 45(1): 55. DOI: 10.1111/j.1570-7458.1987.tb02255.x.
[20] ROBACKER D C, HEATH R R. Attraction of Mexican fruit flies (Diptera: Tephritidae) to lures emitting host-fruit volatiles in a citrus orchard[J]. The Florida Entomologist, 1996, 79(4): 600. DOI: 10.2307/3496075.
[21] 施伟, 刘辉, 叶辉. 橘小实蝇对五种杧果气味挥发性物质的行为反应[J]. 昆虫知识, 2010, 47(2): 318. DOI: 10.7679/j.issn.2095-1353.2010.055 [22] SIDERHURST M S, JANG E B. Cucumber volatile blend attractive to female melon fly, Bactrocera cucurbitae (Coquillett)[J]. Journal of Chemical Ecology, 2010, 36(7): 699. DOI: 10.1007/s10886-010-9804-4.
[23] JAYANTHI P D K, WOODCOCK C M, CAULFIELD J, et al. Isolation and identification of host cues from mango, Mangifera indica, that attract gravid female oriental fruit fly, Bactrocera dorsalis[J]. Journal of Chemical Ecology, 2012, 38(4): 361. DOI: 10.1007/s10886-012-0093-y.
[24] NISHIDA R, TAN K H. Search for new fruit fly attractants from plants: a review[C]//Proceedings of the 9th international symposium on fruit flies of economic importance. Bangkok: International Fruit Fly Steering Committee, 2016: 256.
[25] PINO J A, MESA J, MUÑOZ Y, et al. Volatile components from mango (Mangifera indica L.) cultivars[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2213. DOI: 10.1021/jf0402633.
-
期刊类型引用(0)
其他类型引用(4)




 下载:
下载: