基于网络药理学探究滇黄精抗疲劳作用及其机制
基于网络药理学探究滇黄精 (Polygonatum kingianum) 潜在的抗疲劳机制。
使用中药系统药理学数据库与分析平台 (TCMSP)、CNKI和DrugBank数据库搜寻滇黄精的主要活性成分,并利用SwissTargetPrediction数据库预测各活性成分的作用靶点;通过Disgenet数据库获取与疲劳有关的靶点;借助Venny 2.1.0和Cytoscape v3.9.0构建滇黄精—活性成分—抗疲劳靶点网络,根据其节点度值筛选滇黄精的主要活性成分。通过String数据库构建蛋白质互作(protein-protein interaction,PPI)网络,通过节点度值筛选滇黄精抗疲劳的关键靶点。使用DAVID数据库对筛选的关键靶点进行基因本体论(gene ontology,GO)分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。使用AutoDock Vina软件对滇黄精的主要活性成分与抗疲劳关键靶点进行分子对接。
获得滇黄精活性成分38种;预测得到滇黄精抗疲劳靶点30个;筛选出滇黄精抗疲劳的主要活性成分3个,分别是3′-甲氧基大豆苷元、黄芩素和β-谷甾醇。PPI网络分析结果表明:EGFR、STAT3、PTPN11、ERBB2、ESR1和JAK2为滇黄精抗疲劳的关键靶点。GO分析和KEGG通路分析表明:滇黄精抗疲劳作用主要涉及68个条目和39个通路。分子对接结果显示:滇黄精的主要活性成分与抗疲劳关键靶点结合稳定。
本研究通过网络药理学构建了滇黄精—活性成分—抗疲劳拓扑网络,挖掘出滇黄精抗疲劳的主要活性成分及抗疲劳关键靶点,并对主要活性成分与关键靶点进行分子对接。研究结果为滇黄精的抗疲劳功效提供了理论依据。
Antifatigue Effect and Mechanism of Polygonatum kingianum Based on Network Pharmacology
To investigate the potential antifatigue mechanism of Polygonatum kingianum based on network pharmacology.
The main active ingredients of P. kingianum were searched from Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP), CNKI and DrugBank databases, and the potential targets of these active ingredients of P. kingianum were predicted by the SwissTargetPrediction database. The network of the active ingredients and antifatigue targets of P. kingianum was contructed through Venny 2.1.0 and Cytoscape v3.9.0, and the key active ingredients of P. kingianum were screened according to the degree values of nodes. The protein-protein interaction (PPI) network was constructed by the String database, and the key antifatigue targets of P. kingianum were screened by the degree values of nodes. Gene Ontology (GO) analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analysis were performed on the obtained the key targets using the DAVID database. Molecular docking of key ingredients to the key targets was performed using AutoDock Vina software.
A total of 38 active ingredients, and 30 potential antifatigue targets of P. kingianum were obtained. Three main active ingredients (3′-methoxydaidzein, baicalein and beta-sitosterol) of P. kingianum were screened. The PPI network showed that EGFR, STAT3, PTPN11, ERBB2, ESR1, and JAK2 were the key targets of antifatigue effects of P. kingianum. GO analysis and KEGG pathway analysis showed that the antifatigue effects of P. kingianum involved 68 items and 39 pathways. The results of molecular docking showed that the main active ingredients of P. kingianum bound stably to the key targets of antifatigue.
A topological network of P. kingianum-active ingredients-antifatigue is constructed through network pharmacology in this study. The main active ingredients and the key antifatigue targets of P. kingianum are explored, and the molecular docking between the main active ingredients and the key targets is carried out. The results provide a theoretical basis for the antifatigue efficacy of P. kingianum.
-
Keywords:
- Polygonatum kingianum /
- antifatigue /
- network pharmacology /
- molecular docking
-
随着社会的飞速发展,疲劳已成为常见的健康问题,体力疲劳、心理疲劳、脑力疲劳和病理疲劳[1]会严重影响人们的工作效率并危害人体健康,主要表现为注意力不集中、嗜睡、情绪低落、从事正常活动能力减弱、体力不支等症状[2],更有甚者会增加多发性硬化症、脑出血、神经衰弱等疾病的患病率[3],长期疲劳会降低人体免疫力,促使病原微生物入侵机体,引发疾病[4],过度疲劳甚至会危及生命。滇黄精 (Polygonatum kingianum) 是百合科(Liliaceae)黄精属(Polygonatum)多年生草本植物,主要分布于云南、贵州、四川等地;其主要成分滇黄精多糖具有增强免疫能力、抗肿瘤、减缓衰老、抗炎等生物活性[5-6],滇黄精皂苷具有降血糖、促凝血等作用[7],滇黄精黄酮具有抗氧化、抗疲劳等作用[8-9]。尽管已有报道表明滇黄精具有抗疲劳功效,但目前对滇黄精的抗疲劳作用机制尚不清楚。
网络药理学于2007年由药理学专家ANDREW提出,随后应用于众多研究领域。网络药理学旨在针对药物中的某种或多种成分对某种或多种疾病进行分析,它以拓扑网络的形式,强调药物对信号通路进行多途径调控,旨在改善药物的有效性,减少其不良反应,降低新药的研发成本和缩短药物的研发时间[10]。近年来,网络药理学广泛应用于药物活性成分的作用机制预测研究。李非洲等[11]通过网络药理学分析方法探讨人参养荣汤治疗慢性疲劳的作用机制,发现其主要通过作用于MAPK14、NOS2、PTGS2等多个靶点调控PI3K/Akt信号通路发挥抗疲劳作用;高寒等[12]也利用网络药理学方法探究了刺五加总苷抗疲劳的潜在作用机制,发现刺五加总苷中的7种活性成分通过作用于HSP90AA1、STAT3、VEGFA等靶点而发挥抗疲劳作用。本研究基于药物—靶点—途径的研究思路,通过多平台数据库获取滇黄精活性成分及其抗疲劳作用靶点,使用Cytoscape和Venny 2.1.0软件构建滇黄精—活性成分—抗疲劳拓扑网络,采用网络药理学分析技术及分子对接技术探索滇黄精抗疲劳的作用靶点及其机制,以期为滇黄精的抗疲劳功效提供理论依据。
1. 材料与方法
1.1 检索滇黄精的活性成分
通过中药系统药理学数据库与分析平台 (Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP) 和CNKI数据库查询滇黄精的活性成分。首先,使用TCMSP数据库,设置“Herb Name”为“滇黄精”进行搜索,导出其活性成分;其次,使用CNKI数据库搜寻与滇黄精活性成分相关的文献并导出。去除上述步骤所获得的重复活性成分,即获得滇黄精的活性成分。在活性成分筛选时,通常需要满足口服利用度大于30%和生物类药性大于0.18的条件[13]。在本研究中,虽然滇黄精中的一些化学成分(如滇黄精皂苷、薯蓣皂苷、重楼皂苷等)不满足口服利用度和生物类药性的条件,但相关文献[14]报道了这些活性成分具有显著的药理作用,因此,也将这些成分保留作为滇黄精的活性成分。
1.2 滇黄精活性成分的靶点预测
SwissTargetPrediction数据库是基于已知化合物的二维和三维结构的相似度,对化合物治疗靶点展开预测分析的工具。本研究通过小分子有机生物活性数据库 (PubChem) 查询滇黄精活性成分的分子线性输入规范 (SMILES) 结构式,将其输入到SwissTargetPrediction数据库中,并将种属设置为“homo sapiens”,选取Probability>0的靶点,得到滇黄精活性成分潜在靶点的预测结果。
1.3 滇黄精抗疲劳靶点的筛选
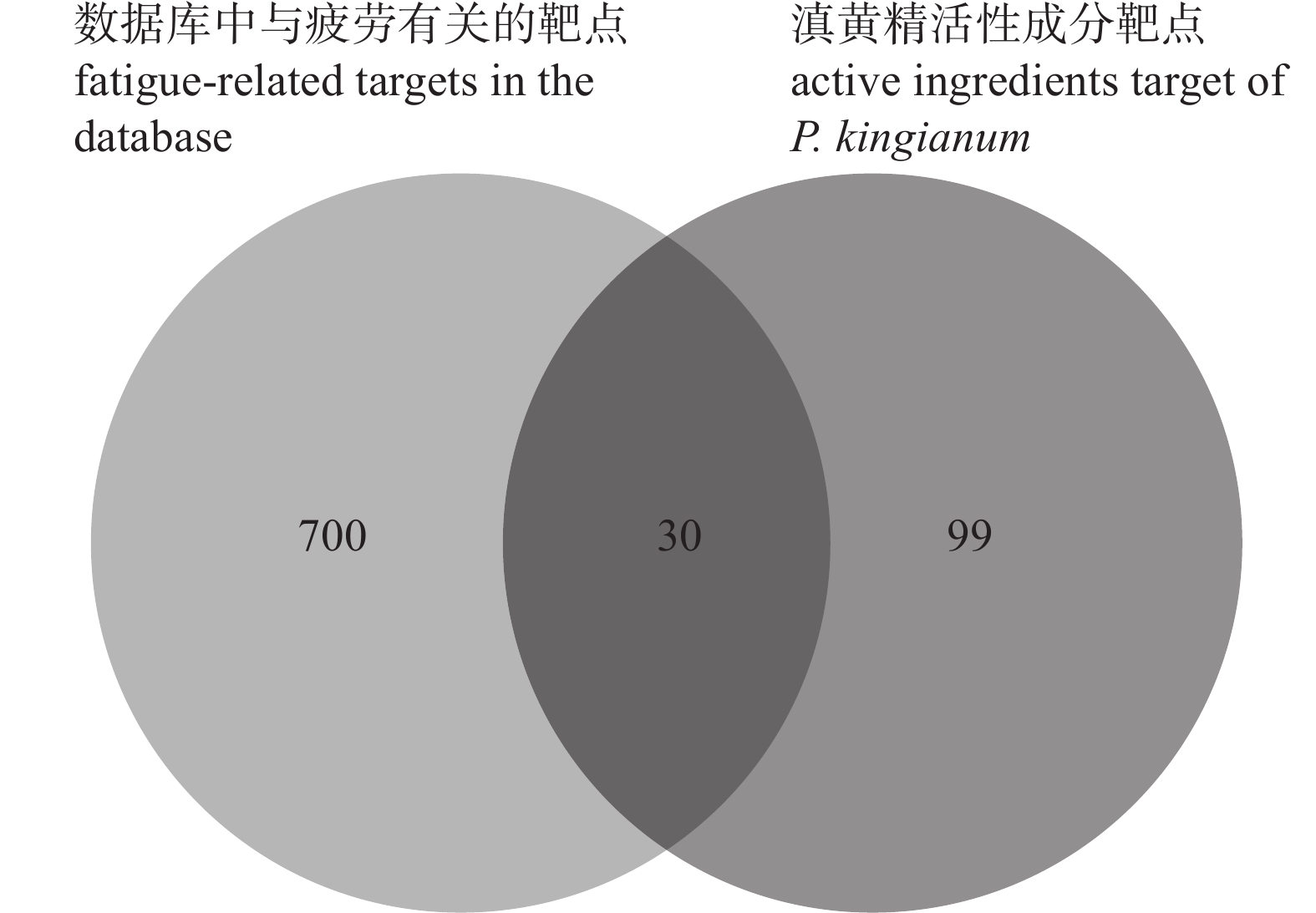
在Disgenet (https://www.disgenet.org/search)数据库的搜索框中输入“Fatigue” (Name: Fatigue; CUI: C0015672::),选择“Summary of Gene-Disease Associations”,获取与疲劳相关的靶点。由于1.2节中通过SwissTargetPrediction预测得到的滇黄精活性成分作用靶点是所有疾病的靶点,因此,需借助Venny 2.1.0软件进一步筛选出疲劳有关靶点与滇黄精活性成分作用靶点的交集,从而获得滇黄精抗疲劳的靶点。
1.4 建立滇黄精—活性成分—抗疲劳靶点网络
将1.1节和1.3节获得的数据导入Cytoscape v3.9.0软件中,构建滇黄精—活性成分—抗疲劳靶点的网络图,其中节点度值越大,则其节点颜色越深。
1.5 蛋白质互作网络构建
将1.3节筛选出的靶点上传到String数据库,种群选择为“homo sapiens”,将相互作用评分调整为最高置信度 (highest confidence) =0.9,隐藏没有相互作用的蛋白靶点,获得蛋白互作 (protein-protein interaction,PPI) 网络图,并将所获得的数据导出至Cytoscape软件。通过节点度值设置节点大小和颜色,得到PPI网络拓扑图。
1.6 GO富集分析与KEGG通路分析
为更好地探究滇黄精抗疲劳靶点涉及的生物学过程及通路,将滇黄精抗疲劳靶点导入至DAVID数据库,在第1、2、3列中分别选择“Official Gene Symbol”“Gene List”和“Homo Sapiens”,根据P<0.05从获得的数据中进一步筛选GO富集结果和KEGG通路。
1.7 分子对接分析
分子对接技术能直观地显示滇黄精活性成分与作用靶点的结合程度。从PubChem中获取滇黄精主要活性成分的3D结构,导入至Open Babel 2.3.2软件,将文件格式转化为PDB格式;将关键靶点导入到PDB数据库中,得到其3D构造的PDB格式文件。将所获取的活性成分和靶蛋白导入至Pymol软件,活性成分进行加氢处理,靶蛋白进行去水分子处理。使用AutoDock Vina对主要活性成分与关键靶点进行分子对接,结合能与氢键个数反映了活性成分与关键靶蛋白结合的稳定性,结合能越低,对接的稳定性能越好;对接氢键数量越多,对接之后的化合物构象越稳定。
2. 结果与分析
2.1 滇黄精的活性成分
通过TCMSP和Drugbank查询滇黄精的活性成分,将查询到的活性成分进行收集、整理及去除重复数据后,共获得38种活性成分(表1)。
表 1 滇黄精活性成分Table 1. Active ingredients of Polygonatum kingianum编号
No.名称
name口服利用度/%
oral bioavailability生物类药性
biological drug property1 甘草素 liquiritigenin 32.76 0.18 2 黄芩苷元 baicalein 33.52 0.21 3 3′-甲氧基大豆苷元 3′-methoxydaidzein 48.57 0.24 4 β-谷甾醇 beta-sitosterol 33.94 0.70 5 谷甾醇 sitosterol 36.91 0.75 6 柚皮素5-O-β-D葡萄糖苷 (2R)-7-hydroxy-2-(4-hydroxyphenyl) chroman-4-one 71.12 0.18 7 薯蓣皂苷元 diosgenin 17.19 0.81 8 5,4′-二羟基黄酮 5,4′-dihydroxyflavone 48.55 0.19 9 无梗五加苷B (+)-syringaresinol-O-beta-D-glucoside 43.35 0.77 10 滇黄精皂苷H kingianoside H — — 11 滇黄精皂苷I kingianoside I — — 12 麦冬皂苷C ophiopogonin C — — 13 滇黄精苷C (25S)-kingianoside C — — 14 滇黄精苷D (25S)-kingianoside D — — 15 滇黄精苷E (25S)-kingianoside E — — 16 滇黄精苷F (25S)-kingianoside F — — 17 滇黄精皂苷E kingianoside E — — 18 滇黄精皂苷F kingianoside F — — 19 滇黄精苷A (25S)-kingianoside A — — 20 滇黄精苷G (25R)-kingianoside G — — 21 滇黄精皂苷K kingianoside K — — 22 纤细薯蓣皂苷 gracillin 27.39 0.06 23 薯蓣皂苷 dioscin 17.75 0.06 24 重楼皂苷 parissaponin — — 25 滇黄精皂苷A kingianoside A — — 26 滇黄精皂苷B kingianoside B — — 27 funkioside C — — 28 滇黄精皂苷C kingianoside C — — 29 滇黄精皂苷D kingianoside D — — 30 disporopsin — — 31 N-对香豆酰真蛸胺 N-trans-p-coumaroyloctopamine — — 32 吲哚嗪类生物碱A polygonatine A — — 33 吲哚嗪类生物碱B polygonatine B — — 34 鹅掌楸苦素 liriodendrin 5.19 0.29 35 羟基积雪草苷 hydroxy asiaticoside 9.37 0.06 36 腺苷 adenosine 18.32 0.18 37 水杨酸 salicylic acid 32.13 0.03 38 4-羟甲基糠醛 4-hydroxymethylfurfural 45.07 0.02 注:“—”表示暂无口服利用度和生物类药性数据报道。
Note: “—” indicates oral bioavailability or biological drug property data have not been reported.2.2 滇黄精潜在抗疲劳靶点预测
通过Disgenet数据库查询到730个疲劳相关靶点,通过SwissTargetPrediction数据库预测得到滇黄精的所有作用靶点共129个,使用Venny 2.1.0筛选到滇黄精的抗疲劳靶点30个(图1)。
2.3 滇黄精—活性成分—抗疲劳靶点网络
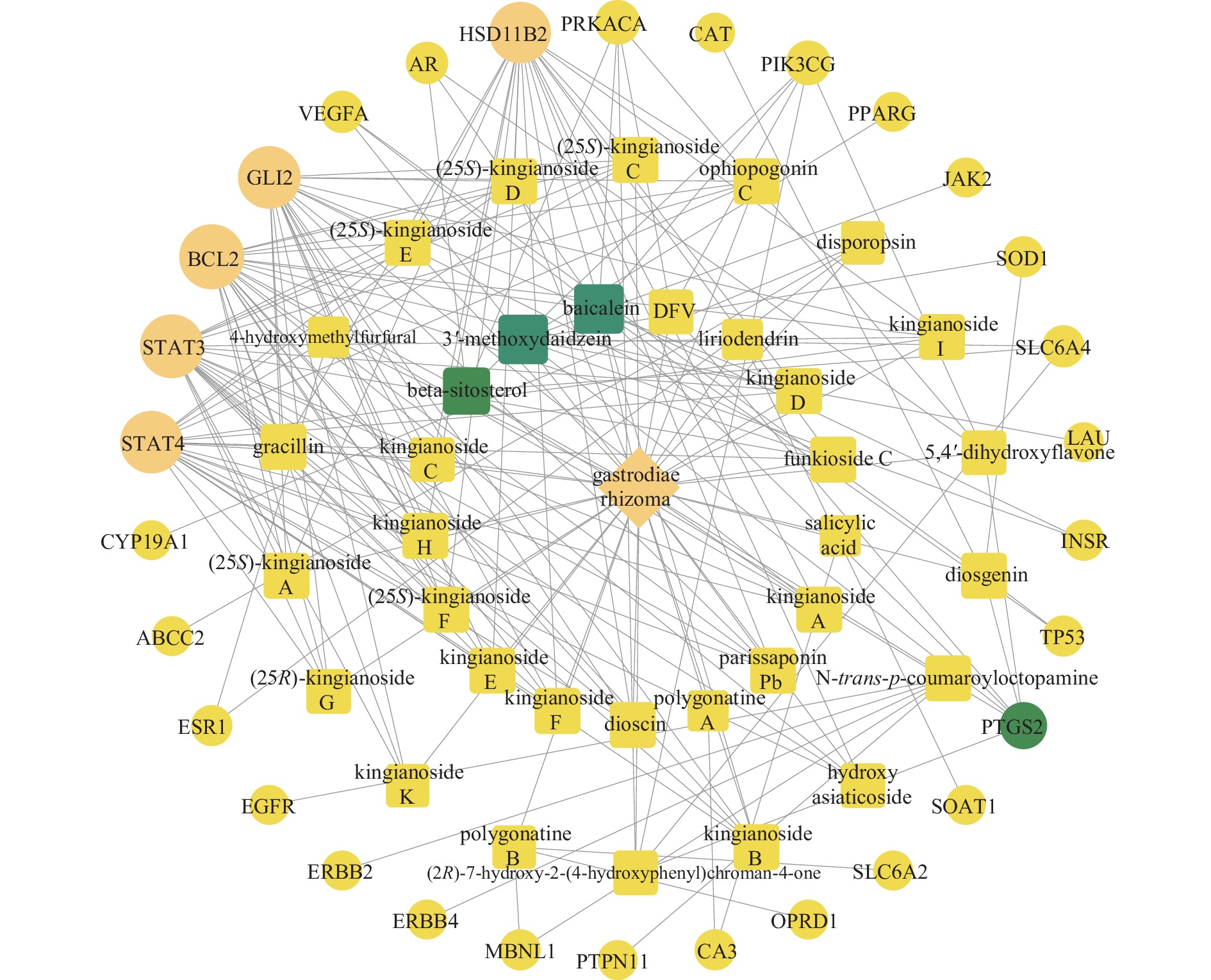
由滇黄精活性成分—抗疲劳靶点的网络图(图2)可知:包含35个活性成分、66个节点、187条边。除滇黄精外,3′-甲氧基大豆苷元、黄芩素和β-谷甾醇3种成分的节点颜色最深,表明它们是滇黄精抗疲劳的主要活性成分。此外,靶点的每1个节点均有多条边与之连接,也表明了滇黄精的抗疲劳功效是不同化合物协同作用的结果。
![]() 图 2 滇黄精—活性成分—抗疲劳靶点网络注:菱形代表滇黄精,正方形代表滇黄精抗疲劳活性成分,圆形代表抗疲劳潜在作用靶点。Figure 2. The target network of P. kingianum-active ingredients-antifatigue targetsNote: The diamond represents P. kingianum, the square represents the antifatigue active ingredients, the round represents the potential antifatigue targets.
图 2 滇黄精—活性成分—抗疲劳靶点网络注:菱形代表滇黄精,正方形代表滇黄精抗疲劳活性成分,圆形代表抗疲劳潜在作用靶点。Figure 2. The target network of P. kingianum-active ingredients-antifatigue targetsNote: The diamond represents P. kingianum, the square represents the antifatigue active ingredients, the round represents the potential antifatigue targets.2.4 蛋白质互作分析
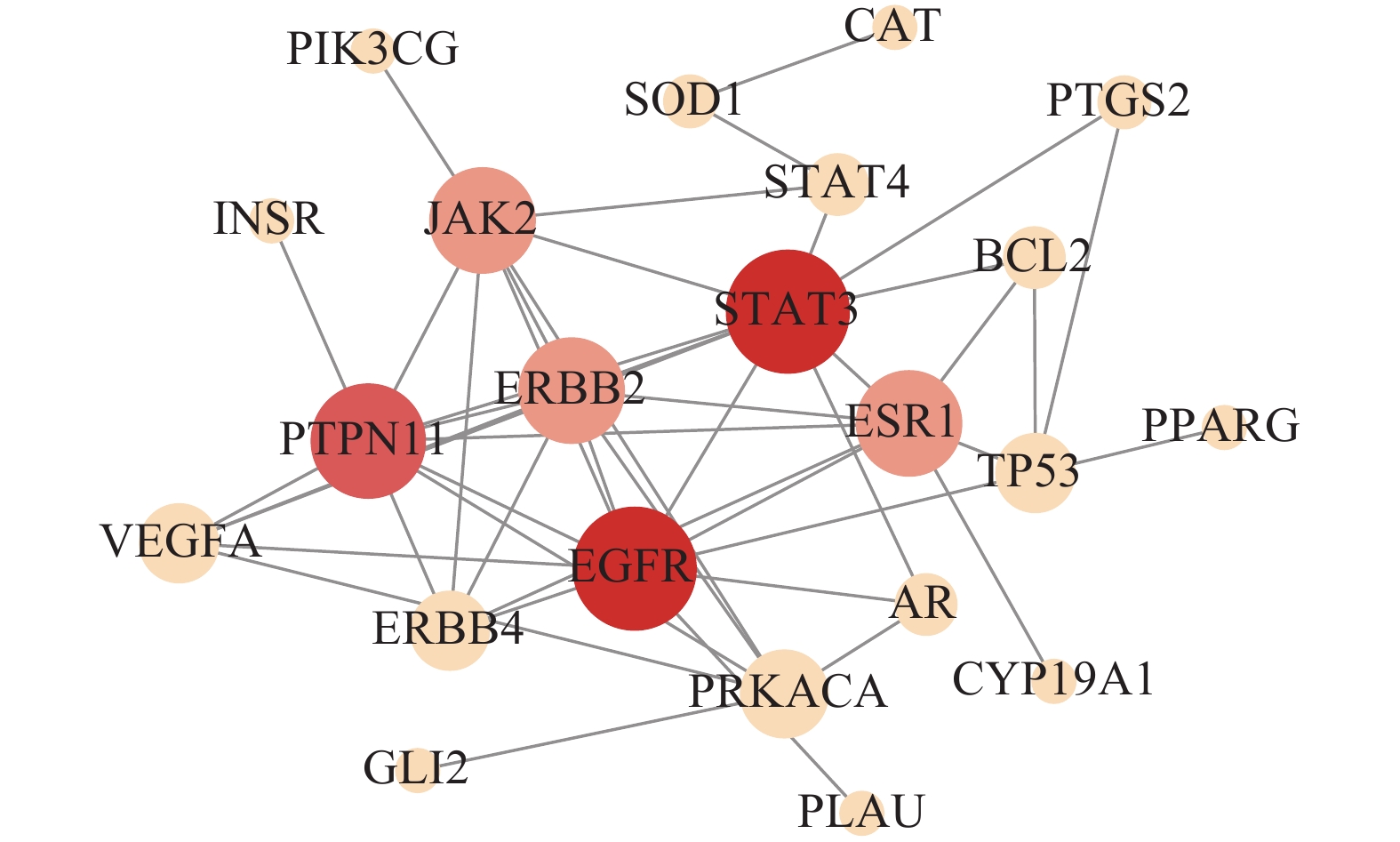
拓扑图(图3)包含22个节点,47条边。滇黄精抗疲劳的关键靶点为表皮生长因子受体 (EGFR)、信号转导及转录激活蛋白3 (STAT3)、蛋白酪氨酸磷酸酶非受体 (PTPN11和JAK2)、酪氨酸激酶受体2 (ERBB2) 以及雌激素受体 (ESR1)。
![]() 图 3 蛋白互作网络注:节点代表蛋白,边代表蛋白与蛋白之间的联系,节点的大小和颜色深浅代表该节点在整个蛋白质互作网络中的重要程度。Figure 3. Protein-protein interaction networkNote: The nodes represent proteins, the edges represent the connections between proteins, the size and color shades of the nodes represent their importance in the overall protein interaction network.
图 3 蛋白互作网络注:节点代表蛋白,边代表蛋白与蛋白之间的联系,节点的大小和颜色深浅代表该节点在整个蛋白质互作网络中的重要程度。Figure 3. Protein-protein interaction networkNote: The nodes represent proteins, the edges represent the connections between proteins, the size and color shades of the nodes represent their importance in the overall protein interaction network.2.5 滇黄精抗疲劳基因GO分析
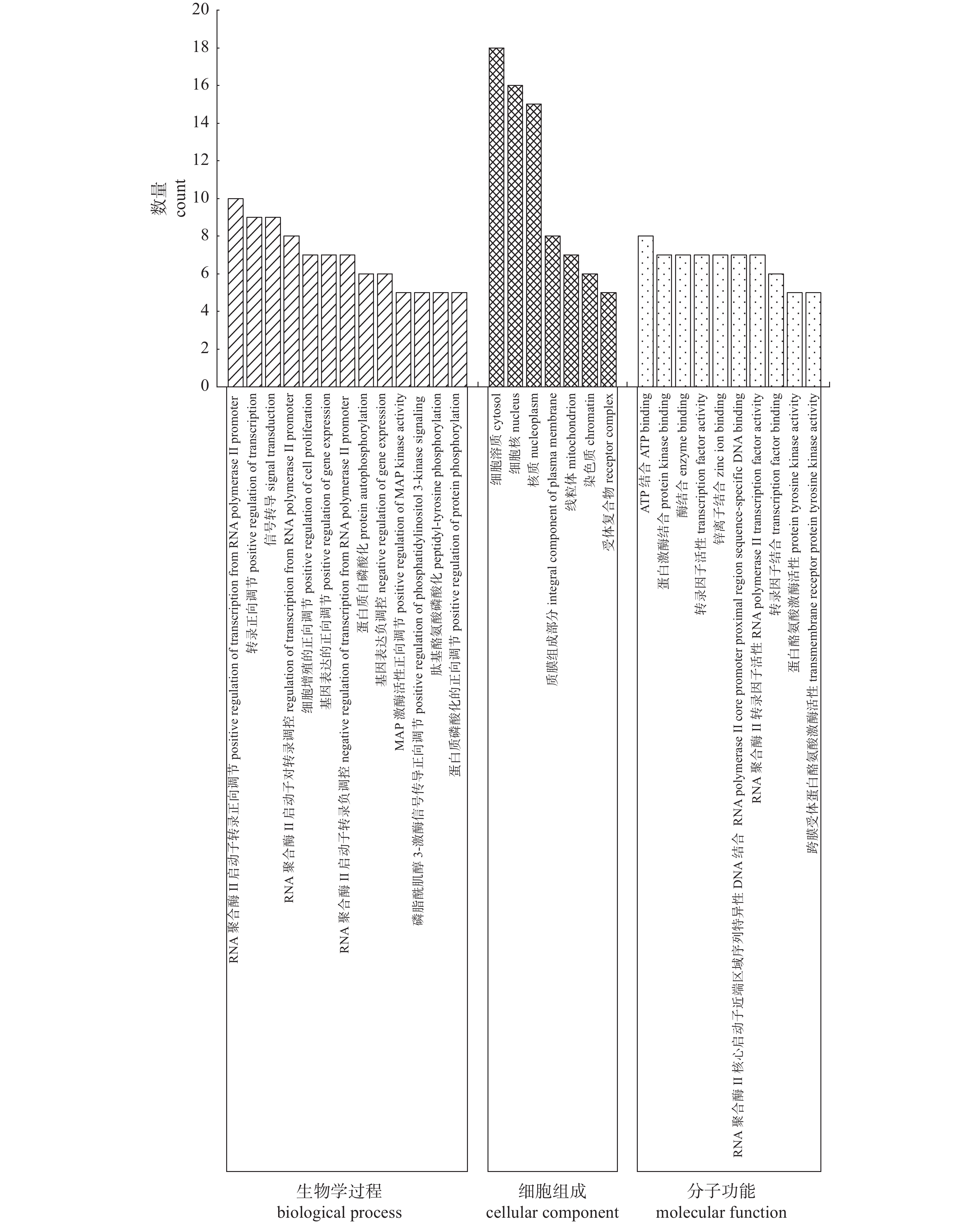
滇黄精抗疲劳关键靶点共涉及68个条目。前30个条目中(图4),生物学过程包括RNA聚合酶Ⅱ启动子转录正向调节、转录正向调节等13个生物学过程;细胞组成包括细胞溶质、细胞核、核质等7个组分;分子功能包含ATP结合、蛋白激酶结合 、酶结合等10种功能。
2.6 滇黄精抗疲劳KEGG通路分析
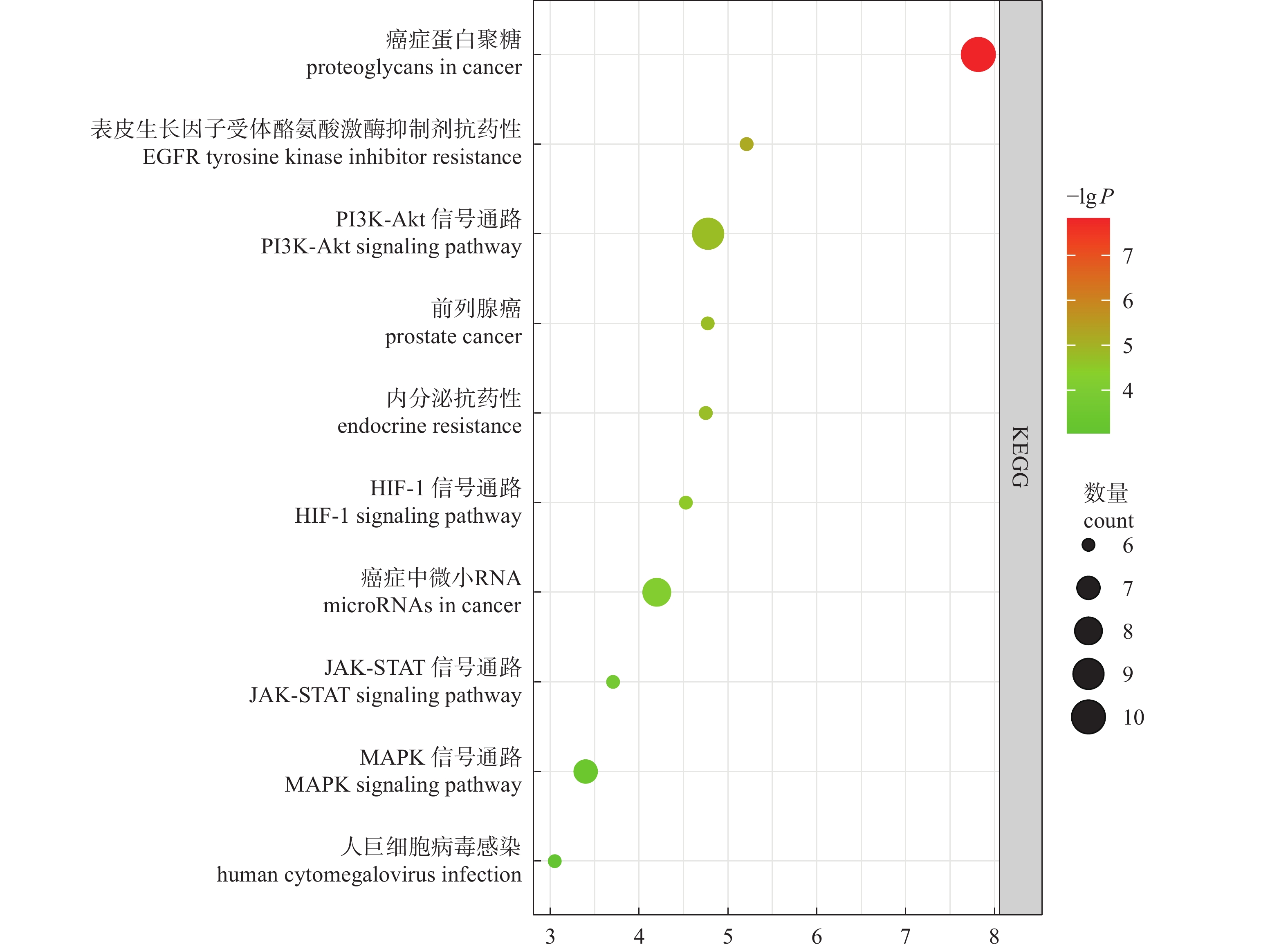
对滇黄精抗疲劳的关键靶点进行KEGG通路分析,得到的结果数据以P<0.05进行进一步筛选,共计得到39个通路,其中基因富集数大于5的通路主要包含癌症中的蛋白聚糖、耐药性EGFR酪氨酸激酶抑制剂、PI3K-Akt信号通路等10个通路(图5)。
2.7 分子对接
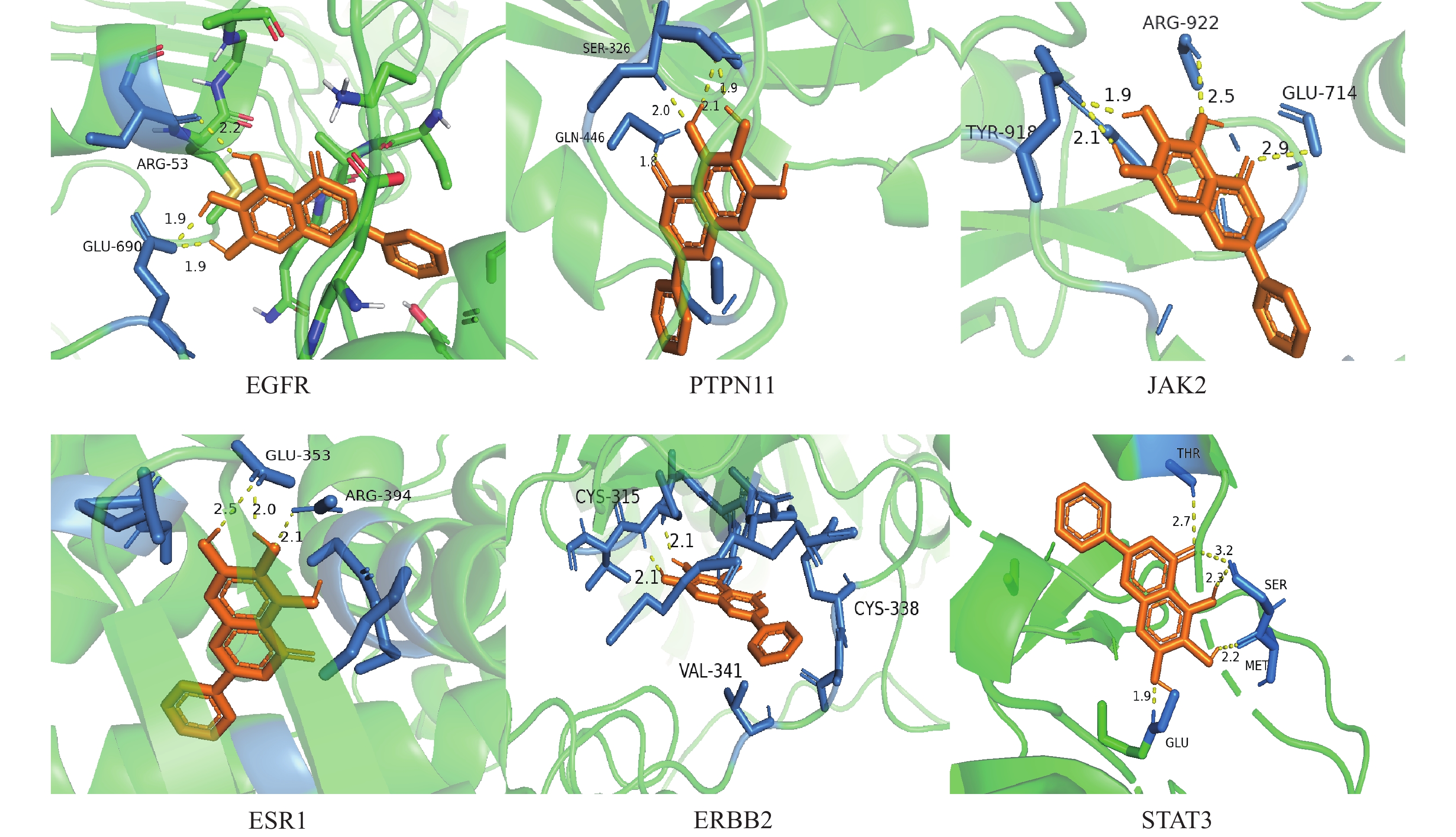
将蛋白质互作网路筛选出的6个关键靶蛋白(EGFR、STAT、PTPN11、ERBB2、ESR1和JAK2)分别与滇黄精的3个抗疲劳活性成分(黄芩苷元、3′-甲氧基大豆苷元和β-谷甾醇)进行分子对接,结果(表2和图6)显示:滇黄精主要活性成分与关键靶蛋白对接的结合能均小于−5 kcal/mol,表明预测的活性成分与关键靶点结合性能良好。其中,黄芩苷元对关键靶蛋白的结合能低且结合氢键数量最多,表明黄芩苷元在滇黄精抗疲劳过程中发挥着重要作用。
表 2 分子对接结果Table 2. Results of molecular docking关键成分
key ingredients核心靶点
core targets结合能/(kcal·mol−1)
binding energy氢键数
number of hydrogen bonds黄芩苷元 baicalein EGFR −5.12 3 STAT3 −5.21 1 PTPN11 −5.45 4 ERBB2 −5.55 2 ESR1 −6.13 2 JAK2 −5.73 2 3′-甲氧基大豆苷元
3′-methoxydaidzeinEGFR −6.05 1 STAT3 −5.27 1 PTPN11 −5.50 1 ERBB2 −5.84 1 ESR1 −5.77 1 JAK2 −5.88 0 β-谷甾醇
beta-sitosterolEGFR −6.89 0 STAT3 −7.91 1 PTPN11 −7.83 0 ERBB2 −7.50 0 ESR1 −6.80 0 JAK2 −6.63 0 3. 讨论
本研究通过网络药理学方法对滇黄精潜在的抗疲劳作用机制进行分析,结果表明滇黄精的抗疲劳作用具备多成分、多靶点的特性,且由不同的活性成分发挥抗疲劳功效。拓扑网络分析显示:3′-甲氧基大豆苷元、黄芩苷元和β-谷甾醇的节点最大,表明这3种成分是滇黄精抗疲劳的主要活性成分。PPI网络表明:滇黄精活性成分与靶蛋白之间具有较强的互作效应,EGFR、STAT3、PTPN11、ERBB2、ESR1和JAK2为滇黄精抗疲劳的关键靶点;分子对接结果表明:滇黄精3种抗疲劳主要活性成分均能与抗疲劳的6个关键靶蛋白自发结合,且黄芩苷元的抗疲劳活性最为重要。黄芩苷元属于黄酮类化合物,主要来源于黄芩根,研究表明其具有良好的抗炎、抗氧化、抗过敏以及抗癌的生物功效[15],并能显著抑制炎症因子TNF-α和IL-6的表达[16],从而缓解由炎症因子引起的疲劳。陈景等[17]研究发现:黄芩苷元能上调大鼠海马CA1区超氧化物歧化酶和谷胱甘肽过氧化酶的表达,降低丙二醛含量,上调磷酸化核因子E2相关因子2 及血红素氧合酶1的蛋白表达。3′-甲氧基大豆苷元为异黄酮类物质,具有镇痛[18]、清除自由基[19]、抗炎[20]等作用。β-谷甾醇属于植物甾醇类化合物之一,具有抗炎[21]、抗菌[22]、降脂[23]以及提高人体免疫力的作用[24]。
GO分析表明:滇黄精的抗疲劳作用涵盖细胞炎症、细胞生长、能量代谢以及自由基代谢等多个生物学过程。对细胞组分的分析发现:滇黄精抗疲劳的主要作用靶点涉及胞浆、核质、线粒体、染色质等。线粒体是骨骼肌中重要的细胞器,能为骨骼肌的舒张和收缩提供能量。WANG等[25]研究发现:Nrf2介导的氧化应激与疲劳有关,且血红素氧合酶1能够促进线粒体合成[26],加速机体产生能量,缓解疲劳。分子功能包含了ATP结合、蛋白激酶结合、锌离子结合等作用。其中,锌是人体所必需的微量元素,也作为许多酶的金属催化剂,可通过合成RNA聚合酶和DNA聚合酶加速DNA、蛋白质以及胶原的合成,同时促进维生素A的吸收、组织修复及再生,与肌肉质量关系密切[27]。此外,锌是重要的抗氧化剂,能有效减少运动过程中机体代谢产生的自由基,尤其是在高强度的激烈运动后,适量补充锌有利于运动后自由基的消除[28]。蛋白激酶存在于细胞质中,能够调节人体的神经系统,对神经系统的发育、行为的形成、长期记忆等具有正向调节作用。田振军等[29]研究证明蛋白激酶类基因可缓解运动性中枢疲劳的产生。
KEGG通路分析表明:滇黄精抗疲劳作用主要涉及MAPK、PI3K-AKT、JAK-STAT等信号通路。其中,MAPK信号通路主要参与细胞炎症、细胞凋亡、免疫调节、HSCs活化增殖和生成胶原的重要调节途径[30]。李丹等[31]通过小鼠疲劳跑台实验和悬尾实验证明艾灸能够介导JAK-STAT的信号通路缓解疲劳。郭静等[32]利用大黄素衍生物作用于RAW264.7炎症细胞,通过抑制PI3K-Akt途径能够减少细胞炎症的产生。研究表明:产生疲劳的两大主要因素是细胞炎症因子水平的上升以及机体内抗氧化酶的消耗和代谢物的积累[33],因此,本研究中滇黄精抗疲劳的主要机制可能是滇黄精通过调控MAPK通路、PI3K-Akt途径和JAK-STAT信号通路,降低细胞炎症水平、加快细胞周期进程及减少代谢产物的积累,从而发挥抗疲劳作用。这些结果表明滇黄精的抗疲劳作用由多个生物学过程共同参与,同时也表明了滇黄精的抗疲劳作用是多成分、多靶点、多途径共同参与。
4. 结论
本研究通过网络药理学方法和分子对接探究了滇黄精的抗疲劳机制,表明滇黄精抗疲劳功效具有多成分、多靶点、多通路共同参与的特点,可通过抗炎、加速能量及自由基代谢、加速细胞周期进程等细胞生物学过程共同发挥抗疲劳作用。研究结果为滇黄精抗疲劳功效提供了理论依据。
-
图 2 滇黄精—活性成分—抗疲劳靶点网络
注:菱形代表滇黄精,正方形代表滇黄精抗疲劳活性成分,圆形代表抗疲劳潜在作用靶点。
Figure 2. The target network of P. kingianum-active ingredients-antifatigue targets
Note: The diamond represents P. kingianum, the square represents the antifatigue active ingredients, the round represents the potential antifatigue targets.
图 3 蛋白互作网络
注:节点代表蛋白,边代表蛋白与蛋白之间的联系,节点的大小和颜色深浅代表该节点在整个蛋白质互作网络中的重要程度。
Figure 3. Protein-protein interaction network
Note: The nodes represent proteins, the edges represent the connections between proteins, the size and color shades of the nodes represent their importance in the overall protein interaction network.
表 1 滇黄精活性成分
Table 1 Active ingredients of Polygonatum kingianum
编号
No.名称
name口服利用度/%
oral bioavailability生物类药性
biological drug property1 甘草素 liquiritigenin 32.76 0.18 2 黄芩苷元 baicalein 33.52 0.21 3 3′-甲氧基大豆苷元 3′-methoxydaidzein 48.57 0.24 4 β-谷甾醇 beta-sitosterol 33.94 0.70 5 谷甾醇 sitosterol 36.91 0.75 6 柚皮素5-O-β-D葡萄糖苷 (2R)-7-hydroxy-2-(4-hydroxyphenyl) chroman-4-one 71.12 0.18 7 薯蓣皂苷元 diosgenin 17.19 0.81 8 5,4′-二羟基黄酮 5,4′-dihydroxyflavone 48.55 0.19 9 无梗五加苷B (+)-syringaresinol-O-beta-D-glucoside 43.35 0.77 10 滇黄精皂苷H kingianoside H — — 11 滇黄精皂苷I kingianoside I — — 12 麦冬皂苷C ophiopogonin C — — 13 滇黄精苷C (25S)-kingianoside C — — 14 滇黄精苷D (25S)-kingianoside D — — 15 滇黄精苷E (25S)-kingianoside E — — 16 滇黄精苷F (25S)-kingianoside F — — 17 滇黄精皂苷E kingianoside E — — 18 滇黄精皂苷F kingianoside F — — 19 滇黄精苷A (25S)-kingianoside A — — 20 滇黄精苷G (25R)-kingianoside G — — 21 滇黄精皂苷K kingianoside K — — 22 纤细薯蓣皂苷 gracillin 27.39 0.06 23 薯蓣皂苷 dioscin 17.75 0.06 24 重楼皂苷 parissaponin — — 25 滇黄精皂苷A kingianoside A — — 26 滇黄精皂苷B kingianoside B — — 27 funkioside C — — 28 滇黄精皂苷C kingianoside C — — 29 滇黄精皂苷D kingianoside D — — 30 disporopsin — — 31 N-对香豆酰真蛸胺 N-trans-p-coumaroyloctopamine — — 32 吲哚嗪类生物碱A polygonatine A — — 33 吲哚嗪类生物碱B polygonatine B — — 34 鹅掌楸苦素 liriodendrin 5.19 0.29 35 羟基积雪草苷 hydroxy asiaticoside 9.37 0.06 36 腺苷 adenosine 18.32 0.18 37 水杨酸 salicylic acid 32.13 0.03 38 4-羟甲基糠醛 4-hydroxymethylfurfural 45.07 0.02 注:“—”表示暂无口服利用度和生物类药性数据报道。
Note: “—” indicates oral bioavailability or biological drug property data have not been reported.表 2 分子对接结果
Table 2 Results of molecular docking
关键成分
key ingredients核心靶点
core targets结合能/(kcal·mol−1)
binding energy氢键数
number of hydrogen bonds黄芩苷元 baicalein EGFR −5.12 3 STAT3 −5.21 1 PTPN11 −5.45 4 ERBB2 −5.55 2 ESR1 −6.13 2 JAK2 −5.73 2 3′-甲氧基大豆苷元
3′-methoxydaidzeinEGFR −6.05 1 STAT3 −5.27 1 PTPN11 −5.50 1 ERBB2 −5.84 1 ESR1 −5.77 1 JAK2 −5.88 0 β-谷甾醇
beta-sitosterolEGFR −6.89 0 STAT3 −7.91 1 PTPN11 −7.83 0 ERBB2 −7.50 0 ESR1 −6.80 0 JAK2 −6.63 0 -
[1] 吴名草, 王晶, 沈旭丹, 等. 人参葛根植物饮料对小鼠体力疲劳的缓解作用研究[J]. 粮油食品科技, 2022, 30(5): 212. DOI: 10.16210/j.cnki.1007-7561.2022.05.018. [2] 肖嵋方, 王力, 田皓然, 等. 海洋生物活性物质抗疲劳功能研究进展[J]. 食品与机械, 2022, 38(9): 211. DOI: 10.13652/j.spjx.1003.5788.2022.90214. [3] 徐艺园, 王凯, 王佳音, 等. 疲劳产生相关机制研究进展[J]. 科学技术创新, 2019(23): 50. DOI: 10.3969/j.issn.1673-1328.2019.23.030. [4] 曹晶晶, 杨卫杰, 曹轶. 刺梨多糖的抗氧化和抗疲劳研究[J]. 中国中医基础医学杂志, 2018, 24(4): 474. [5] 肖坤敏, 马佳钰, 王军民, 等. 滇黄精多糖提取工艺及其抗氧化活性研究[J]. 西南林业大学学报(自然科学), 2022, 42(4): 147. DOI: 10.11929/j.swfu.202103016. [6] GU W W, WANG Y F, ZENG L X, et al. Polysaccharides from Polygonatum kingianum improve glucose and lipid metabolism in rats fed a high fat diet[J]. Biomed Pharmacother, 2020, 125(11): 109910. DOI: 10.1016/j.biopha.2020.109910.
[7] YAN H L, LU J M, WANG Y F, et al. Intake of total saponins and polysaccharides from Polygonatum kingianum affects the gut microbiota in diabetic rats[J]. Phytomedicine, 2017, 26: 45. DOI: 10.1016/j.phymed.2017.01.007.
[8] SHI Y, SI D, CHEN D H, et al. Bioactive compounds from Polygonatum genus as anti-diabetic agents with future perspectives[J]. Food Chemistry, 2023, 408(6): 135183. DOI: 10.1016/j.foodchem.2022.135183.
[9] 杨显辉, 代培春, 曾磊, 等. 滇黄精总黄酮抗运动疲劳作用研究[J]. 现代食品, 2019(8): 134. DOI: 10.16736/j.cnki. cn41-1434/ts.2019.08.038. [10] HOPKINS A L. Network pharmacology[J]. Nature Biotechnology, 2007, 25(10): 1110. DOI: 10.1002/pi.1160.
[11] 李非洲, 左刚, 李泽飞, 等. 基于网络药理学的人参养荣汤治疗慢性疲劳综合征机制探索[J]. 时珍国医国药, 2021, 32(12): 2882. DOI: 10.3969/j.issn.1008-0805.2021. 12.16. [12] 高寒, 徐伟, 张宇航, 等. 基于网络药理学的刺五加总苷抗疲劳作用机制研究[J]. 中草药, 2021, 52(2): 9. DOI: 10. 7501/j.issn.0253-2670.2021.02.014. [13] 贺云霞, 程刚, 孙进. 提高口服药物生物利用度制剂方法的研究进展[J]. 中国药剂学杂志(网络版), 2003, 1(4): 33. DOI: 10.14146/j.cnki.cjp.2003.04.012. [14] 杨瑞娟, 王桥美, 庄立, 等. 滇黄精研究进展[J]. 农村实用技术, 2017(6): 50. DOI: 10.3969/j.issn.1673-310X.2017. 06.027. [15] 朱亚南, 杨七妹, 张硕, 等. 黄芩苷与黄芩素药理作用及机制研究进展[J]. 时珍国医国药, 2020, 31(4): 921. DOI: 10.3969/j.issn.1008-0805.2020.04.048. [16] 宋丽, 王跃, 田飞, 等. 黄芩素通过抑制氧化应激与凋亡改善小鼠心肌重构的作用研究[J]. 湖北民族大学学报(医学版), 2022, 39(3): 1. DOI: 10.13501/j.cnki.42-1590/r.2022.03.001. [17] 陈景, 杨磊, 左亚杰, 等. 黄芩苷改善慢性脑低灌注大鼠认知障碍的作用及机制研究[J]. 中南药学, 2021, 19(7): 1333. DOI: 10.7539/j.issn.1672-2981.2021.07.013. [18] XU R J, FEI S H, CHEN L Y, et al. 3'-methoxydaidzein exerts analgesic activity by inhibiting voltage-gated sodium channels[J]. Chinese Journal of Natural Medicines, 2019, 17(6): 413. DOI: 10.1016/S1875-5364(19)30049-4.
[19] LIU B R, KENNETH T K, SUN Q L, et al. Dual high-resolution α-glucosidase and radical scavenging profiling combined with HPLC-HRMS-SPE-NMR for identification of minor and major constituents directly from the crude extract of Pueraria lobata[J]. Journal of Natural Products, 2015, 78(2): 294. DOI: 10.1021/np5009416.
[20] LIU X Y, ZHANG Y B, YANG X W, et al. Simultaneous determination of twenty-five compounds with anti-inflammatory activity in Spatholobi Caulis by using an optimized UFLC-MS/MS method: an application to pharmacokinetic study[J]. Journal of Pharmaceutical and Biomedical Analysis, 2021, 204: 114267. DOI: 10.1016/j.jpba.2021.114267.
[21] 蒋琼凤, 袁志辉, 李进, 等. 蓼蓝中β-谷甾醇的提取及其抗氧化性研究[J]. 食品工业科技, 2015, 36(6): 108. DOI: 10.13386/j.issn1002-0306.2015.06.016. [22] KANG D, TAN Y Y, YANG D, et al. β-sitosterol improves experimental colitis in mice with a target against pathogenic bacteria[J]. Journal of Cellular Biochemistry, 2018, 120(4): 5687. DOI: 10.1002/jcb.27853.
[23] FENG S M, DAI Z Q, ANNA B L, et al. Intake of stigmasterol and beta-sitosterol alters lipid metabolism and alleviates NAFLD in mice fed a high-fat western-style diet[J]. Biochimica et Biophysica Acta Molecular and Cell Biology of Lipids, 2018, 1863(10): 1274. DOI: 10.1016/j.bbalip.2018.08.004.
[24] LORENZO F, ELISA C, LORENA C, et al. Immunomodulatory properties of beta-sitosterol in pig immune responses[J]. International Immunopharmacology, 2012, 13(3): 316. DOI: 10.1016/j.intimp.2012.04.017.
[25] WANG X, QU Y D, ZHANG Y F, et al. Antifatigue potential activity of sarcodon imbricatus in acute excise-treated and chronic fatigue syndrome in mice via regulation of Nrf2-mediated oxidative stress[J]. Oxidative Medicine & Cellular Longevity, 2018, 2018(8): 9140896. DOI: 10.1155/2018/9140896.
[26] 李香云, 余剑波. 血红素氧合酶-1/一氧化碳系统对线粒体生物合成的影响[J]. 国际麻醉学与复苏杂志, 2018, 39(3): 282. DOI: 10.3760/cma.j.issn.1673-4378.2018.03. 019. [27] 石鹤坤, 陈锦珊. 微量营养素的抗疲劳作用研究进展[J]. 医药导报, 2012, 31(10): 1340. DOI: 10.3870/yydb.2012.10.030. [28] KOURY J C, DE OLIVEIRA A V J, PORTELLA E S, et al. Zinc and copper biochemical indices of antioxidant status in elite athletes of different modalities[J]. International Journal of Sport Nutrition & Exercise Metabolism, 2004, 14(3): 358. DOI: 10.1123/ijsnem.14.3.358.
[29] 田振军, 张志琪. 小鼠运动性疲劳相关基因筛选的初步研究[J]. 中国运动医学杂志, 2002, 21(1): 4. DOI: 10.16038/j.1000-6710.2002.01.001. [30] 徐莉, 高飞. 活性氧与细胞增殖[J]. 国外医学(肿瘤学分册), 2002, 29(4): 252. DOI: 10.3760/cma.j.issn.1673-42 2X.2002.04.00. [31] 李丹, 胡凯文, 韩丽, 等. 艾灸对癌性疲劳小鼠JAK-STAT信号通路的影响[J]. 环球中医药, 2022, 15(5): 725. DOI: 10.3969/j.issn.1674-1749.2022.05.001. [32] 郭静, 尚海, 马丽炎, 等. 芦荟大黄素衍生物AE-YJ通过PI3K-Akt/NF-κB和MAPK/NF-κB途径抑制LPS诱导RAW264.7细胞炎症介质的释放[J]. 中国药理学通报, 2021, 37(12): 1700. DOI: 10.3969/j.issn.1001-1978.2021. 12.013. [33] PENG F, YIN H Y, DU B, et al. Anti-fatigue activity of purified flavonoids prepared from chestnut ( Castanea mollissima) flower[J]. Journal of Functional Foods, 2021, 79(5): 104365. DOI: 10.1016/j.jff.2021.104365.
-
期刊类型引用(1)
1. 张楠,张超,李阳顺,马仲帅,马舒韵,余平莲,李凌飞. 基于网络药理学及分子对接技术探究天麻抗疲劳成分及其机制. 西南农业学报. 2024(09): 2051-2060 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: