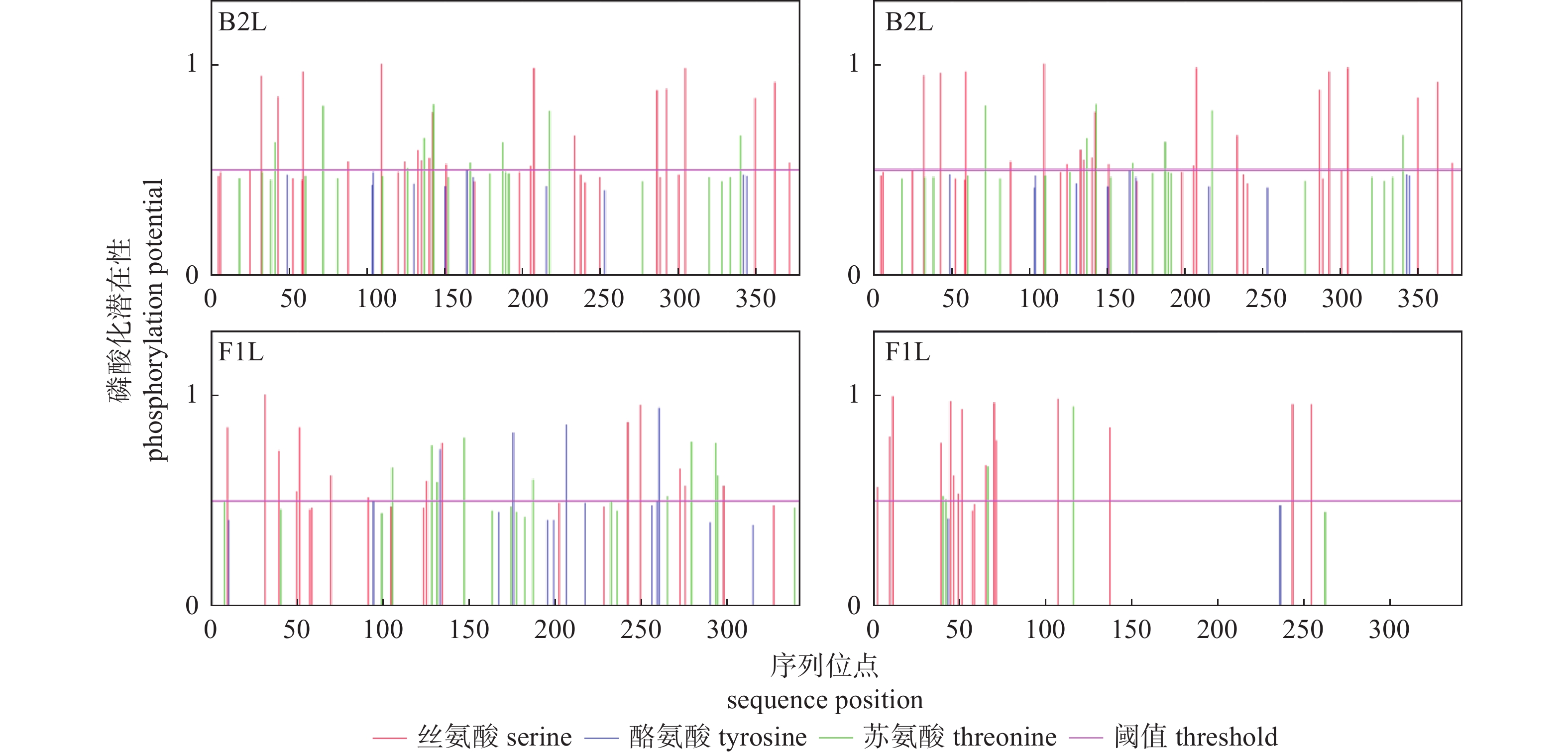
羊口疮病毒内脏和口唇感染株B2L和F1L基因的比较分析
Comparative Analysis of B2L and F1L Genes in Orf Virus Viscera and Lip Infected Strains
-
Keywords:
- orf virus /
- lip infected strain /
- F1L gene /
- B2L gene /
- bioinformatics analysis
-
土壤重金属由于其生物有害性和难降解性一直是环境学家们关注的热点[1-2]。一般而言,土壤表层重金属元素的空间分布主要受到自然本底值和人类活动影响[3]。铅作为重要的工业原料,广泛应用于机械、电气、军事、冶金、化学、医药及轻工业、核工业等行业。由于城市聚集了大量的人口和密集的工业,生产与生活活动集中排放大量Pb元素,积累于城市自身和周边土壤中。众多研究显示:城市及周边地区人类活动对土壤Pb的影响程度已经远高于环境本底的自然输入[4-8]。铅污染对长期暴露其中的人群,特别是儿童具有严重威胁。世界卫生组织(WHO)认为“环境中对儿童威胁最大的是铅”[9],土壤就是儿童铅暴露的重要来源介质之一[10]。因此,对土壤Pb元素开展评价工作对于预防人体铅中毒具有现实意义。
医药、冶金、纺织和机械制造业在石家庄区域经济中举足轻重,汽车数量自21世纪以来增长明显。上述工业生产活动和汽车尾气排放的包括Pb在内的重金属元素直接或间接的输入市区及邻区的土壤内。近年来,不少环境学者和土壤学者陆续开展了一些关于石家庄城市和郊区土壤重金属的研究。张志栋等[11]研究了石家庄市区内不同土地利用类型的土壤垂向剖面上重金属的分布,显示因为人类活动的影响,重金属含量随着土壤深度增加而降低,其中Pb在垂向上迁移距离相对较大。姚娜等[12]研究了石家庄市区北郊的土壤重金属分布并评估了潜在风险,该研究结果显示郊区土壤内的Pb含量达到了河北省土壤背景值的2.5倍。崔邢涛等[13]和付亚星[14]重点研究了石家庄市区重金属的空间分布特征,评价了污染程度,其研究均证明了石家庄市区土壤重金属分布受到强烈的人为因素影响。需要注意的是由于上述研究的时间不同,其具体的空间分布和污染程度均有一定差异。可见,由于外源物质的不断输入以及经济社会的发展变化,土壤元素的分布呈现时间和空间的二维变化。本研究通过分析2004年和2013年石家庄市及邻区土壤Pb含量和分布,评价10年间石家庄土壤Pb风险变化。
1. 材料与方法
1.1 研究区概况
本次研究范围总面积415 km2,涉及石家庄市主城区和近郊的三区一县(正定县、藁城区、栾城区及鹿泉区的平原部分)。研究区地貌上属太行山前冲洪积平原,滹沱河从研究区北部贯穿东西;南部东明渠、洨河曾为石家庄主城区的污水排放渠道,周边农田在历史上为污灌区。
研究区属华北暖温带半湿润地区,受大陆性季风气候影响。年平均气温12.2 ℃,年总降水量为401.1 ~ 752.0 mm,多年平均降水量493 mm,年总日照时间为916.4 ~ 571.2 h。气候总特征为:气候温和,光照充足,降水适中,四季分明,春季干燥多风,夏季炎热多雨,秋季凉爽多雾,冬季寒冷少雪,寒暑悬殊,雨量集中,干湿期明显,夏冬季长,春秋季短。供暖期通常为每年的11月15日—次年3月15日,为期4个月。
当地土壤发育于洪积、冲积扇的黄土母质上,由于受到所处暖温带半湿润气候条件、山前平原地形、水文条件和长期耕作的影响,自然土壤(褐土和草甸褐土)逐渐演变为农业土壤。根据《河北省土壤图集》[15],研究区内土壤类型主要为潮褐土和石灰性褐土。潮褐土的pH为7.9,有机质含量为0.9 % ~ 1.98 %,石灰性褐土的pH为7.5 ~ 8.5。农作物以玉米和冬小麦为主。
1.2 样品采集与测试
2004年样品采集由河北省地质调查院完成,按照每平方公里1个样品的密度,采集0 ~ 20 cm表层土壤。4个样品组成1个测试样品,即每4 km21个测试样品,共取得测试分析数据740个。2013年样品采集由河北省水文工程地质勘查院完成,样品点位与2004年相同,并沿城区主干道进行加密采样。共取得测试分析数据1 061个。样品测试由河北省地质调查院利用ICP-MS测试土壤Pb含量。指标分析方法、检出限、精密度、准确度、重复样合格率等均满足《生态地球化学评价样品分析技术要求(试行)》(DD 2005—03)[16]要求。
1.3 分析方法
(1)空间分布图与面积统计
利用ArcGIS 9.3软件采用反距离权重法制作2个年度的土壤Pb的空间分布图,元素含量分级标准参考勘查地球化学圈定元素含量值异常的方法,利用2004年土壤Pb平均值X0和标准差SD,将分为显著高值区[大于(X0+1.5SD)]、高值区[(X0+1.5SD)~(X0 + 0.5SD)]、平均值区[(X0+0.5SD)~(X0−0.5SD)]和低值区[(X0−0.5SD)~(X0−1.5SD)]和显著低值区[小于(X0−1.5SD)]5个等级区域。面积统计由ArcGIS 9.3的Zonal Statistics功能完成。
(2)污染评价
Pb污染评价采用“地累积指数法”,利用ArcGIS 9.3软件Raster Calculator计算Pb的地累积指数,按如下公式计算:
$ {I_{{\rm{geo}}}}{\rm{ = lo}}{{\rm{g}}_2}[{{{C}}_{\text{测}}}/\left( {{\rm{k}} \cdot{{\rm{B}}_{{\rm{Pb}}}}} \right)] $


式中,Igeo为地累积指数;C测为土壤实测Pb含量;k为修正系数,一般取1.5;BPb为土壤Pb背景参考值,此次采用河北省土壤Pb元素背景值(21.50 mg/kg)[17]。地累积指数值与土壤污染程度划分如表1。
表 1 地累积指数法污染程度划分Table 1. Classification of pollution levels based on ground accumulation index清洁
clean轻度污染
slight pollution中度污染
moderate pollution重度污染
heavy pollution严重污染
severe pollutionIgeo≤0 0<Igeo≤1 1<Igeo≤2 2<Igeo≤3 Igeo>3 2. 结果与分析
2.1 基本统计
由表2可知:10年间石家庄市表层土壤Pb含量平均值和最低值变化不大,但2013年土壤Pb最大值(82.50 mg/kg)是2004年最大值(59.50 mg/kg)的1.39倍;同时,同一年度Pb含量最大值与最小值之间的差值,从2004年的26.46 mg/kg,增长到2013年的70.40 mg/kg,显示出土壤Pb元素在10年间的不均质发展,在某些区域有较大幅度的累积。
表 2 2004与2013年石家庄表层土壤Pb含量基本参数对比Table 2. Comparison of topsoil Pb-contents between 2004 and 2013 in Shijiazhuang统计项目 statistical items 2004 2013 样品数n 740 1 061 平均值/ (mg·kg−1) mean 23.04 24.31 最小值/ (mg·kg−1) minimun 13.30 12.10 最大值/ (mg·kg−1) maximum 59.50 82.50 标准差/(mg·kg−1) SD 4.66 5.70 变异系数/ % CV 20.23 23.45 2个年份的平均值均略高于河北省土壤背景值(21.50 mg/kg)[17],同样涉及石家庄城郊地区的付亚星[14]研究得到Pb均值为24.4 mg/kg,与本研究结果相近,显示出研究区整体的Pb污染程度不高。但本研究结果远低于石家庄市主城区的平均值(31 mg/kg[13]),说明Pb含量在城市和城郊土壤中的差异较大,王美青[18]对于杭州城市和城郊的土壤重金属研究也有类似的现象。这一差异反映出土地利用方式对土壤Pb含量具有影响。
2.2 空间分布
由图1、2可见:Pb在当地表层土壤分布的总体特点是以平均值区为主,大部分研究区的土壤Pb含量在20.71 ~ 25.37 mg/kg之间;在北部滹沱河和沙河河道区,由于河流冲刷使得当地Pb含量较低(≤20.71 mg/kg);在人口活动密集的城市和主要城镇周边形成Pb含量的高值区,特别是石家庄主城区为Pb含量最大的显著高值区(≥30.03 mg/kg)。但是需要注意的是,2013年时在城市中心位置出现了一条沿京广铁路走向的低值通道,将城市的Pb高值区分为东、西两个部分。
与2014年相比,2013年Pb含量整体呈现增长趋势(表3),具体体现在:(1)低值区和显著低值区面积减少,显著低值区从2004年的43.45 km2到2013年不存在显著低值区,低值区面积减少了113.57 km2,低值区面积减少位置主要位于河流流域。(2)平均值区、高值区和显著高值区都呈现出扩大的趋势,高值区和显著高值区分别增加了16.84 km2和32.06 km2,高值区增加的区域主要分布在城镇周边及新城区的建设位置。
表 3 2004年与2013年各等级含量区间与区域面积对比Table 3. Comparison of Pb-content ranges between 2004 and 2013含量等级 pollution level 含量范围/(mg·kg−1) content range 2004年面积/km2 area in 2004 2013年面积/km2 area in 2013 显著低值区 very low value zone < 16.05 43.45 0 低值区 low value zone ≥16.05 ~ 20.71 501.65 388.08 平均值区 average zone ≥20.71 ~ 25.37 1 325.20 1 433.52 高值区 high value zone ≥25.37 ~ 30.03 395.00 411.84 显著高值区 very high value zone > 30.03 150.10 182.16 石家庄及周边郊县地区的各类含量等级区的变化与石家庄市10年来的自然环境、经济社会发展变化具有密切关系。
2.3 地累积指数污染评价
如图3、4所示:整体来看,Pb在石家庄市及周边区域未形成重度污染和严重污染,基本上处于轻度污染以下等级。2004年,石家庄市周边郊县地区基本没有Pb污染;石家庄主城区有大片轻度污染区,主要分布在石家庄的老市区与东北部工业区,与石家庄市区的历史发展、工业经济分布相吻合。
2013年,石家庄市区内的轻污染区受铁路建设的影响,污染状况有所改善,污染等级有所降低。城郊部分的污染等级处于上升趋势;其中,随着正定新区的建设,在诸福屯镇形成1处中等污染区;西部鹿泉北部因高速建设开通,新形成了1处较大面积的轻污染区,以上是10年间土壤污染状况变化最大的2个区域,未来需要关注发展趋势。
3. 讨论
3.1 城市土地利用与土壤Pb的关系
近20年来,关于土地利用方式对元素分布的影响,许多学者从不同尺度、不同角度开展过相关研究[19-23]。一个普遍的认识是不同的土地利用方式对土壤中的重金属含量有着显著影响,相同土地利用方式下的土壤重金属污染状况表现出相似性[19]。就城乡区别而言,城市由于土地利用方式多样,包括公路、工厂等人类活动强度大的方式,Pb元素的人为输入量远高于以农业活动为主的农田区。在本研究中,石家庄市及周边城镇的Pb变化与土地利用有密切关系。
(1)城市工业经济布局对于Pb分布有重要影响。石家庄作为典型工业城市,市内分布有热电厂、钢铁厂等燃煤大户和众多含铅工业企业,这些企业主要分布于桥西老城区和城市东北部的工业区。2004—2013年石家庄市区的Pb显著高值区分布轮廓相似,基本是在二环路框架下,铁路以西的整体和铁路以东的北部。Pb的显著高值区与企业分布具有明显的重合。城市东南部裕华区建成较晚,该区以居民区和商业、教育为主,区内没有大型工业企业;相应的,该区土壤的Pb含量也相对较低。
在石家庄市主城区的Pb含量显著高值区范围基本保持稳定的同时,周边城镇由于工业和经济的发展,扩大了Pb含量高值区的范围。鹿泉、栾城等区的一批临近主城区的乡镇,因为交通便利成为各自区内重点发展区域,如鹿泉铜冶镇范围内有众多铸造企业,栾城窦妪镇有较为发达的装备制造业。这些工业对小城镇周边土壤Pb元素含量有着相当大的影响。同时,随着房地产业在10年间的兴起,城镇周边兴建了大量的楼盘,楼盘建设、装修等使用的染料和油漆[19]对周边土壤Pb也有较高输入,而这可能是正定新区,即诸福屯镇周边Pb含量高值区形成的重要原因。
(2)二环内密集的路网框定了石家庄市区Pb显著高值区的主要范围。含铅汽油的燃烧是城市土壤Pb污染的重要来源[23],燃烧排放的Pb随着大气沉降进入土壤。城市大气中的铅80%来自汽车的尾气,城市交通繁忙的中心地带的大气含铅量是农村地区的 60 ~ 300 倍[24]。2001年石家庄机动车保有量达14.96万辆,公路边1 m的NOX含量达到0.305 mg/m3,超过国家标准2.03倍[25];2012年达到134.6万辆,NOX排放量为67 547 t[26]。巨大的机动车保有量和尾气排放量对于城市Pb含量的分布有着重要影响,2001年在石家庄公路边1 m检测Pb含量为0.353 ~ 0.687 μg/m3[25]。虽然从2005年开始石家庄市逐步推广使用无铅汽油,但由于环境中Pb的稳定性,使得2004年之前即奠定了石家庄市区土壤Pb含量显著高值区主要分布于城市化程度较高的二环路之内的基本格局。
(3)铁路的变更对沿线Pb含量的影响。已有研究表明:铁路对沿线两侧土壤的Pb含量具有显著影响,且Pb含量随着与铁道距离越近而升高[27-29]。石家庄铁路发展已有1个多世纪的历史,京广铁路从城市中部穿城而过,对两侧土壤Pb必然有极大影响。铁路Pb元素的输入主要有两个来源:一是蒸汽机车时代的燃煤排放;另一个是铁路的刹车系统[30]和车辆磨损[29]。2012年,石家庄火车站从市区中部搬迁至南二环,京广铁路以地下隧道的形式穿过城市,地面土壤不再接收铁路来源的Pb。绿化修整后,2013年铁路沿线Pb含量大幅降低,主要是由于修整过程中的客土覆盖,另外树木和草坪对大气沉降Pb有阻隔和过滤作用[31],降低了其他来源的Pb输入。
(4)通过对河岸的不断治理,流经研究区的河道、河岸得到硬化,固定了河水流向,加之对河水排水系统的不断完善,使得河水、大气降水极少形成大面积的地表径流,对周边土壤元素的冲刷功能大大弱化,因此流域内Pb含量得到逐步累积,减少了低值区的面积。
3.2 农田区Pb含量变化较小的原因
本研究中除中心城镇之外的广大农田区,在10年间Pb含量变化极小,源于两方面的原因。
(1)从空间上横向对比,由于人为活动强度不同,城乡土壤收纳Pb有差异。相对于乡村,城市土壤接收更多的人为源元素输入,空间表现为表层土壤元素含量更高。柳云龙等[32]对上海市中心城区、城郊接合部和远郊开展了重金属空间变异结构和分布特征研究,发现由中心城区到远郊,随着城市化水平降低和人为干扰强度的减弱,土壤Pb等重金属的变异程度减弱,影响其空间分布特征的结构性因素增强。
(2)从时间上纵向对比,农业耕作变化不大,对土壤Pb输入量稳定。农业生产过程中对土壤Pb的输入途径主要是通过含铅化肥的使用,通过农作物收割输出部分Pb。不同品牌和种类的化肥中Pb的含量差异很大,周永锋等[33]测定了多种磷肥的重金属含量,其中Pb含量变幅为3.68 ~ 125.6 mg/kg。10年来,研究区农田内的作物种植基本没有变化,保持玉米和冬小麦轮作,农民种植技术成熟,每年化肥使用量基本一致。文献资料显示:市售肥料含Pb量均远低于《肥料中砷、镉、铬、铅、铬、汞生态指标》(GB/T23349—2009)的限量标准(200 mg/kg)[34-35]。可以判断农田区通过每年农业生产输入的Pb大致稳定在一个较低的量。
4. 结论
(1)石家庄市区及周边区县土壤Pb含量均值变化较小,从23.04 mg/kg增长到24.31 mg/kg,但最大值和变异系数变化较大。从2004年到2013年,低Pb含量区面积在缩小,高值区域在扩大,反映了石家庄的经济社会变化,涉及铁路建设、新区建设等主要经济建设活动。
(2)地累积指数评价反映出研究区Pb污染状况相对较轻,但面积和污染程度有所发展。2004年轻度污染区域主要在石家庄市区,2013年随着经济建设,正定新区出现了少量的中度污染,郊县的轻度污染亦有所扩大。
(3)城市土地利用方式深刻影响着Pb的空间分布,如城市工业布局、机动车尾气排放、铁路变更等可能是石家庄市Pb含量变化的原因;农田区Pb含量变化较小,主要原因是与城市相比,农田人类活动强度较低、农业生产活动输入Pb稳定在一个较低水平。
-
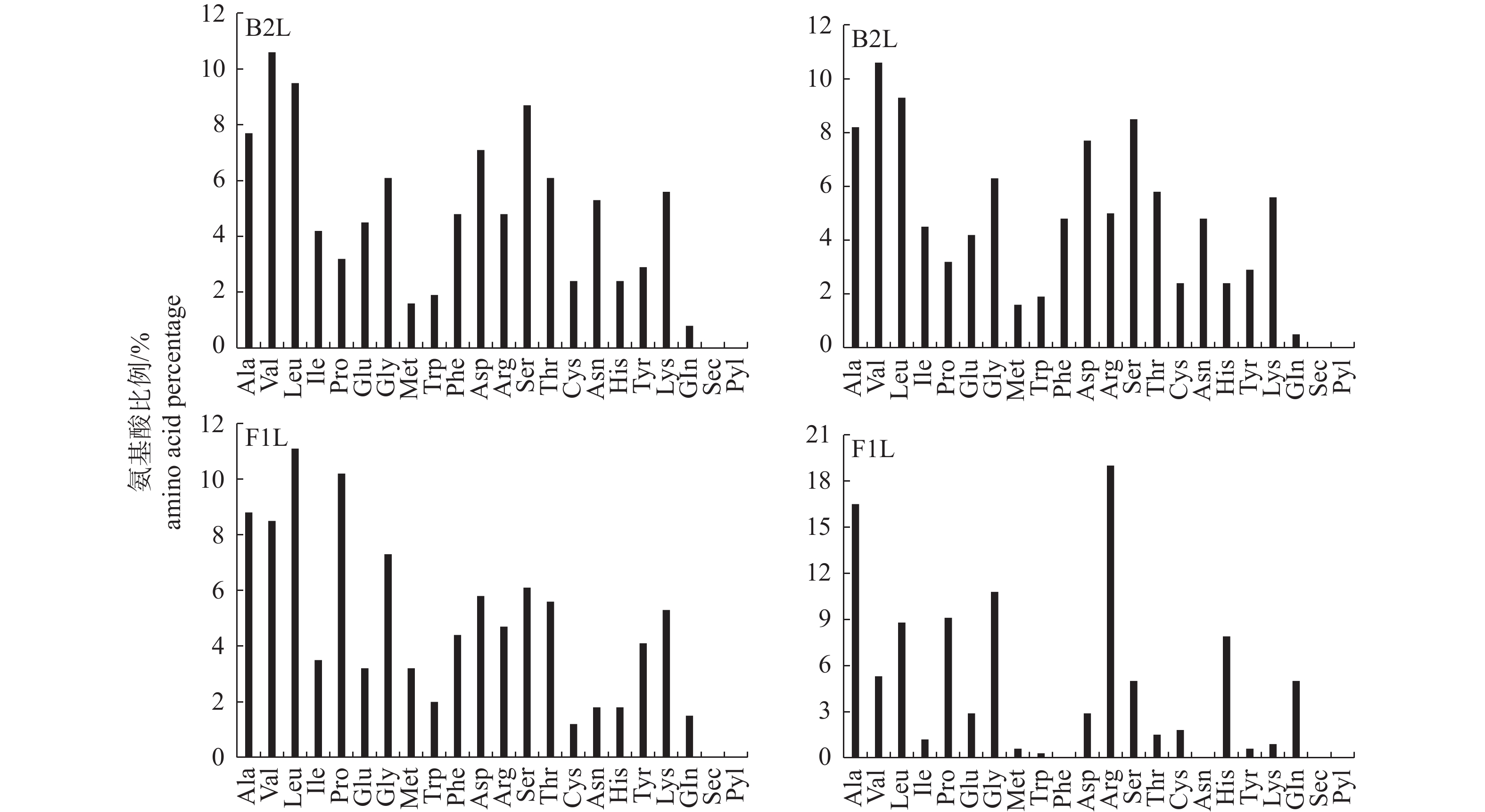
图 3 口唇株(左)和内脏株(右) B2L蛋白和F1L蛋白的氨基酸组成
注:Ala. 丙氨酸;Val. 缬氨酸;Leu. 亮氨酸;Ile. 异亮氨酸;Pro. 脯氨酸;Glu. 谷氨酸;Gly. 甘氨酸;Met. 甲硫氨酸;Trp. 色氨酸;Phe. 苯丙氨酸;Asp. 天冬氨酸;Arg. 精氨酸;Ser. 丝氨酸;Thr. 苏氨酸;Cys. 半胱氨酸;Asn. 天冬酰胺;His. 组氨酸;Tyr. 酪氨酸;Lys. 赖氨酸;Gln. 谷氨酰胺;Sec. 硒半胱氨酸;Pyl. 吡咯赖氨酸。
Figure 3. Amino acid composition of B2L protein and F1L protein in lip (left) and visceral (right) strains
Note: Ala. alanine; Val. valine; Leu. leucine; Ile. isoleucine; Pro. proline; Glu. glutamic acid; Gly. glycine; Met. methionine; Trp. tryptophan; Phe. phenylalanine; Asp. aspartic acid; Arg. arginine; Ser. serine; Thr. threonine; Cys. cysteine; Asn. asparagine; His. histidine; Tyr. tyrosine; Lys. lysine; Gln. glutamine; Sec. selenium cysteine; Pyl. pyrrolysine.
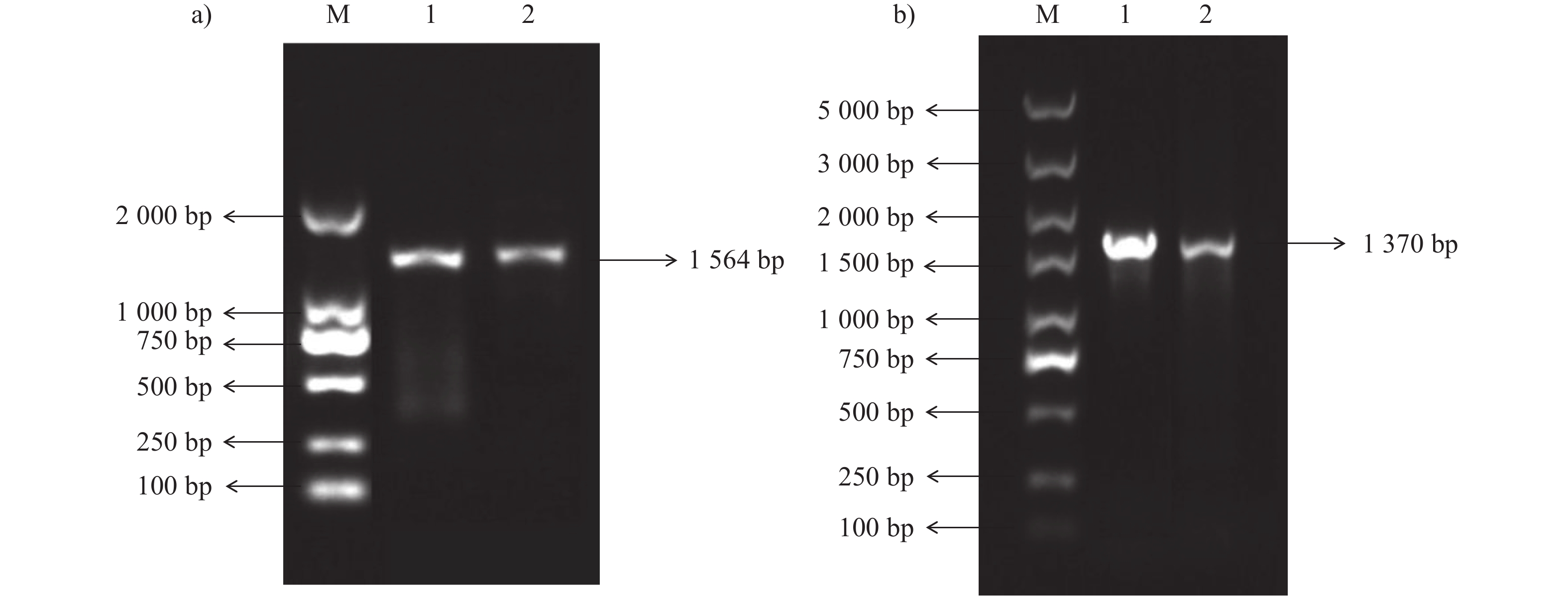
表 1 引物信息
Table 1 Primer information
基因名称
gene name引物名称
primer name引物序列 (5′→3′)
primer sequences退火条件
annealing conditions片段长度/bp
fragment lengthB2L 011 B2L-F CGTCTTTCCGTCTCTCGCCT 60.5 ℃/15 s 1370 B2L-R TGCTGACCGCTGACGAAATG F1L 059 F1L-F CCTCGCTGTTCGTGCTCTG 55 ℃/15 s 1564 F1L-R ATCGTGGGCTCGGTCAAG -
[1] SADIQ M A, ABBA Y, JESSE F, et al. Severe persistent case of contagious ecthyma (orf) in goats[J]. Journal of Animal Health and Production, 2017, 5(1): 24. DOI: 10.1007/s10875-014-0111-7.
[2] 邹东. 羊口疮的治疗及预防方法[J]. 畜牧兽医科技信息, 2021(1): 89. DOI: 10.3969/J.ISSN.1671-6027.2021.01.073. [3] LIN F Y, TSENG Y Y, CHAN K W, et al. Suppression of influenza virus infection by the orf virus isolated in Taiwan[J]. Journal of Veterinary Medical Science, 2015, 77(9): 1055. DOI: 10.1292/jvms.14-0663.
[4] SPYROU V, VALIAKOS G. Orf virus infection in sheep or goats[J]. Veterinary Microbiology, 2015, 181(1/2): 178. DOI: 10.1016/j.vetmic.2015.08.010.
[5] KASSA T. A review on human orf: a neglected viral zoonosis[J]. Research and Reports in Tropical Medicine, 2021, 12: 153. DOI: 10.2147/RRTM.S306446.
[6] FLEMING S B, WISE L M, MERCER A A. Molecular genetic analysis of orf virus: a poxvirus that has adapted to skin[J]. Viruses, 2015, 7(3): 1505. DOI: 10.3390/v7031505.
[7] ZHAO K, HE W Q, GAO W, et al. Orf virus DNA vaccines expressing ORFV 011 and ORFV 059 chimeric protein enhances immunogenicity[J]. Virology Journal, 2011, 8: 562. DOI: 10.1186/1743-422X-8-562.
[8] 李智, 仲亮, 张静, 等. 羊口疮病毒QD/2015株B2L基因克隆及生物信息学分析[J]. 中国动物检疫, 2017, 34(3): 91. DOI: 10.3969/j.issn.1005-944X.2017.03.024. [9] 周祺, 顾香雪, 许泽军, 等. 抗羊口疮病毒囊膜蛋白B2L小鼠多克隆抗体的制备和应用[J]. 细胞与分子免疫学杂志, 2018, 34(11): 1036. DOI: 10.13423/j.cnki.cjcmi.008712. [10] PANG F, ZHANG M M, YANG X J, et al. Genome-wide analysis of circular RNAs in goat skin fibroblast cells in response to orf virus infection[J]. PeerJ, 2019, 7(5): e6267. DOI: 10.7717/peerj.6267.
[11] YOGISHARADHYA R, KUMAR A, BHANUPRAKSH V, et al. Evaluation of a recombinant major envelope protein (F1L) based indirect-ELISA for sero-diagnosis of orf in sheep and goats[J]. Journal of Virological Methods, 2018, 261: 112. DOI: 10.1016/j.jviromet.2018.08.015.
[12] 王冬梅. 羊传染性脓疱病的诊治[J]. 中国畜牧兽医文摘, 2014, 30(2): 135. [13] 赵魁, 贺文琦, 高丰. 羊传染性脓疱皮炎病毒研究进展[J]. 中国畜牧兽医, 2008, 35(11): 133. [14] HOSAMANI M, BHANUPRAKASH V, SCAGLIARINI A, et al. Comparative sequence analysis of major envelope protein gene (B2L) of Indian orf viruses isolated from sheep and goats[J]. Veterinary Microbiology, 2006, 116(4): 317. DOI: 10.1016/j.vetmic.2006.04.028.
[15] LAWAL N, IBRAHIM M, ONAWALA D A, et al. Molecular characterization and phylogenetic analysis of orf virus isolated from goats in Sokoto metropolis, Nigeria[J]. Future Science, 2021, 7(6): FSO700. DOI: 10.2144/fsoa-2020-0162.
[16] ZHANG K, LIU Y J, KONG H J, et al. Comparison and phylogenetic analysis based on the B2L gene of orf virus from goats and sheep in China during 2009-2011[J]. Archives of Virology, 2014, 159(6): 1475. DOI: 10.1007/s00705-013-1946-6.
[17] SCHMIDT C, CARGNELUTTI J F, BRUM M C S, et al. Partial sequence analysis of B2L gene of Brazilian orf viruses from sheep and goats[J]. Veterinary Microbiology, 2013, 162(1): 245. DOI: 10.1016/j.vetmic.2012.10.031.
[18] YOGISHARADHYA R, BHANUPRAKASH V, KUMAR A, et al. Comparative sequence and structural analysis of Indian orf viruses based on major envelope immuno-dominant protein (F1L), an homologue of pox viral p35/H3 protein[J]. Gene, 2018, 663: 72. DOI: 10.1016/j.gene.2018.04.026.
[19] WANG Y, YANG K, WANG Y A, et al. Identification and phylogenetic analysis of an orf virus strain isolated in Anhui Province, East-central China, in 2018[J]. Acta Virologica, 2019, 63(3): 270. DOI: 10.4149/av_2019_304.
[20] 李鹏飞, 冯将, 刘嫒, 等. 羊口疮病毒重庆株F1L基因克隆与生物信息学分析[J]. 西北农业学报, 2017, 26(9): 1281. DOI: 10.7606/j.issn.1004-1389.2017.09.003. [21] ZHAO K, SONG D G, HE W Q, et al. Identification and phylogenetic analysis of an orf virus isolated from an outbreak in sheep in the Jilin Province of China[J]. Veterinary Microbiology, 2010, 142(3/4): 408. DOI: 10.1016/j.vetmic.2009.10.006.
[22] 林裕胜, 江锦秀, 张靖鹏, 等. 羊口疮病毒疫苗株和ORFV-PN株ORFV011基因的比较分析[J]. 福建农业学报, 2020, 35(2): 124. DOI: 10.19303/j.issn.1008-0384.2020.02.002. [23] 黄莉, 谢芝勋, 谢丽基, 等. 禽呼肠孤病毒σB和σC蛋白二级结构及其细胞抗原表位预测[J]. 中国畜牧兽医, 2016, 43(11): 2880. DOI: 10.16431/j.cnki.1671-7236.2016.11.011.



 下载:
下载: