滇池表层沉积物中微塑料的空间分布及来源分析
Spatial Distribution and Source Analysis of Microplastics in Surface Sediments of Dianchi Lake
-
Keywords:
- microplastics /
- spatial distribution /
- source /
- lake sediments
-
植物在自然界中的生长受多种因素的制约,如寒冷、干旱、盐和渗透等非生物胁迫以及食草类昆虫、竞争性植物和各种微生物的生物胁迫,甚至多种胁迫的综合制约[1]。苔藓植物是早期登陆植物的代表,也可用于环境监测和园林绿化[2-3]。部分苔藓有极强的抗逆特性,通过抗逆基因的筛选对农业的发展有着深远的意义[4]。小立碗藓(Physcomirella patens)隶属于葫芦藓科(Fumariaceae)小立碗藓属(Physcomirium),对环境变化较为敏感,是研究环境胁迫对植物影响的理想材料。小立碗藓由单层细胞构成,形态结构和生活史便于观察;其基因组已被测序且具备高同源重组率的特点,减少了基因编辑过程中的功能冗余,利于基因组操作[5],因此,小立碗藓也是研究植物与病原菌相互作用的理想材料。
大自然中还分布有一类耐干苔藓,它能忍耐原生质脱水(脱水可达95%以上)而不受损害,且遇水能快速复苏,因而又被称为“变水植物”[6]。在干旱沙漠区分布有多种耐干苔藓,其中,齿肋赤藓(Syntrichia carninervis)和银叶真藓(Bryum argentum)是耐干苔藓的代表种,也是组成沙漠生物土壤结皮的优势物种,对维护沙漠稳定具有重要作用[7]。它们也因其特殊的耐干性状以及现有完备的组织培养和分子操作平台,成为耐干性研究的模式种,并已开展了大量耐干分子机制的研究[8-14]。目前,已知苔藓对部分植物病原菌具有抑菌能力,通过研究病原菌对苔藓的致病性能够判断苔藓的抗病能力,从而进一步筛选出抗病能力强的苔藓[15],有利于植物抗病性的研究,然而有关耐干苔藓与病原菌互作的研究却鲜有报道。
丁香假单胞菌(Pseudomonas syringae)是一种典型且传播广泛的革兰氏阴性细菌,能够对多种作物造成伤害,是最具破坏力的农业病原菌之一[16]。作为研究植物和病原菌互作机制的典型物种,同时也是50多种丁香假单胞菌属中最先被完全测序的菌株,丁香假单胞菌番茄致病变种Pst DC3000 (P. syringae pv. Tomato DC3000)具有清晰的遗传背景,有利于病害研究[17]。已有研究认为丁香假单胞菌能够在非农业生态位中广泛传播[18]。为了探究丁香假单胞菌是否对荒漠耐干苔藓有致病性,明确侵染后苔藓的致病响应,本研究以2种耐干苔藓(齿肋赤藓和银叶真藓)以及1种模式苔藓(小立碗藓)为研究对象进行试验,旨在初步筛选具有抗病能力的苔藓,为后续进一步开展极端干燥环境下植物—病原菌互作机制研究奠定基础。
1. 材料与方法
1.1 材料
1.1.1 植物材料
齿肋赤藓、银叶真藓和小立碗藓为本课题组培养材料。用自来水清洗3~5遍后,换无菌水洗至无泥沙为止。3种苔藓培养使用的营养基质块购自加拿大Jiffy公司,于121 ℃、40 min条件下高压蒸汽灭菌。在超净工作台内使用无菌镊子将3种苔藓的配子体单株接种在基质块上,培养条件为16 h光照、8 h黑暗,光照条件为3 500 lx,温度为18~25 ℃,在培养箱中培养30 d。
1.1.2 菌种
采用番茄丁香假单胞菌(Pst DC3000)作为病害研究的模式菌,菌种由清华大学刘玉乐教授惠赠。Pst DC3000的培养使用KB液体培养基,配方为:蛋白胨20 g/L,K2HPO4 1.5 g/L,MgSO4·7H2O 1.5 g/L,甘油10 mL/L。
1.2 试验方法
1.2.1 Pst DC3000培养
Pst DC3000储存于50%甘油中,并于−80 ℃冰箱中保存。使用时用无菌牙签挑取,在KB固体培养基(KB液体培养基+琼脂15 g/L)上平板划线,于28 ℃黑暗条件下培养2~5 d,直至纯化出单菌落。将单菌落挑取至含有液体KB培养基10 mL的EP管中,由于丁香假单胞菌具有利福平的抗性,故在液体KB培养基中添加50 mg/L利福平,于28 ℃黑暗条件下培养12 h后,按照1∶100 (体积比)的比例将菌液在液体KB培养基中进行二次活化。菌液OD600值为0.8~1.0时,将菌液置于5 000 r/min离心10 min。弃置上清液,使用10 mmol/L MgCl2溶液进行重悬,细菌悬液调节至OD600值为0.2时,病原菌密度为1×108 CFU/mL[19];菌液浓度调节完毕后,添加0.02% Silwetl-77表面活性剂。
1.2.2 侵染试验
将高温、高压灭菌的沙土均匀地铺撒在直径为9 cm的培养皿中,Pst DC3000的接种采用MIRZAEE 等[20]的方法。将3种苔藓在Pst DC3000菌悬液中浸泡3 s,以整株苔藓表面均匀沾染菌悬液为标准。将浸泡过菌悬液的苔藓种植于沙土上,观察记录并统计其被病原菌侵染的情况。本研究设置接种病原菌的苔藓为试验组,喷洒无菌水的苔藓为对照组。若无特殊情况,每皿中放置30株苔藓,每种苔藓5个重复。
1.3 检测指标
1.3.1 表型观察
在接种病原菌0、3、7、11和14 d时,使用Olympus体式显微镜分别对3种苔藓的配子体进行表型观察、统计并拍照,对病害发生的过程进行实时记录,每种苔藓选取20株配子体进行观察统计。
1.3.2 细胞活力测定
细胞活力的测定参考BRETT等[21]的方法并稍作改进。取伊文思蓝粉末用无菌水配置成0.1%伊文思蓝溶液,现用现配;将苔藓置于其中染色2 h,然后用无菌水冲洗4~5遍,直至洗涤液为无色为止;在体式显微镜下拍照观察,死亡的组织被染为蓝色。
1.3.3 过氧化氢(H2O2)原位检测
苔藓配子体H2O2积累的检测参考MARDANI等[22]的方法并稍作改进。称取DAB粉末并配置为1 mg/mL DAB溶液,加入0.1%表面活性剂Triton X-100,将pH调至5.8,遮光备用。挑选试验组和对照组的3种苔藓,放入含有DAB工作液的EP管中,抽真空20 min,遮光染色7 h。在95%乙醇中煮沸10 min,取出后在95%乙醇中过夜脱色,样品在95%乙醇中保存。在体式显微镜下观察配子体的染色结果并拍照,组织损伤所产生H2O2的部位被染为棕黄色。
1.3.4 超氧阴离子检测
超氧阴离子检测参考PRATEEK等[23]的方法并稍作改进。称取NBT粉末并配置成0.5 mg/mLNBT溶液,将pH调至5.8,遮光备用。挑选试验组和对照组的3种苔藓,放入含有NBT工作液的EP管中,使用真空泵抽真空20 min,遮光染色7 h,在95%乙醇中煮沸10 min,取出后在95%乙醇中过夜脱色,样品在95%乙醇中保存。在体式显微镜下观察配子体的染色结果并拍照,超氧阴离子积累的部位被染为蓝色。
1.3.5 荧光定量PCR
hrpZ基因在所有受Pst DC3000感染的组织中都可以被检测到,对易感植物的感病及超敏反应的发生至关重要。为了确定细菌含量,利用q-PCR对Pst DC3000致病基因hrpZ的表达水平进行定量分析。按照Omega公司细菌DNA提取试剂盒的说明书,提取丁香假单胞菌DNA,并统一稀释到10 ng/μL,并按梯度稀释为100、10−1、10−2、10−3和10−4 ng/μL,通过荧光定量PCR的结果建立标准曲线。接种后,取不同时间点的3种苔藓,将其表面的菌液冲洗干净,留样备用。苔藓DNA的提取选用Omega公司的植物DNA提取试剂盒,特异性引物由上海生工公司合成,其序列为:HrpZ1-F:TCTGAGCAGCGACGCGGGT;HrpZ1-R:AGAGCCGAACGAAACTGAG。按照试剂盒TB Green Premix Ex Taq II 配置25 μL的反应体系,qPCR反应程序为:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 30 s;设置40个循环;95 ℃ 10 s,65 ℃ 0.05 s;95 ℃ 5 s。测得对应的Ct值并换算为细菌的拷贝数,每个时间点设置3个重复[24]。
1.4 数据分析
采用Microsoft Excel 2019软件处理试验数据;采用Graphpad Prism 8软件进行统计分析和作图。
2. 结果与分析
2.1 Pst DC3000侵染3种苔藓的形态学观察
Pst DC3000接种3 d时,银叶真藓茎秆下部有褐化现象,但褐化程度较轻;随着接种时间的增加,其配子体茎秆褐化程度明显增加。Pst DC3000接种3 d时,小立碗藓配子体的叶片出现褐化现象,部分叶片开始褪色;接种14 d时,配子体褪绿严重,呈明显萎蔫趋势,部分叶片泛黄坏死程度较为严重。Pst DC3000接种7 d时,齿肋赤藓配子体的叶片整体褪绿现象明显,且随着时间的增加,叶绿体开始解体,叶片细胞死亡,部分配子体整株呈萎蔫状态(图1)。
接种第0天时,3种苔藓与对照组相比并未发生明显变化;接种病原菌3 d时,齿肋赤藓开始出现第1个明显的细菌性斑点,症状发生在叶片下部接近假根的位置,症状为潮湿的叶片上出现棕色的坏死斑点;接种5 d时,3种苔藓的部分叶片形成明显的褪绿晕,随着时间的增加坏死斑数量增多;接种14 d时可观察到明显的褪绿晕,且配子体茎秆褐化程度加重(图2)。
![]() 图 2 Pst DC3000侵染3种苔藓配子体的表征(比例尺=200 μm)注:a) 齿肋赤藓对照组;b) 齿肋赤藓接种病原菌7 d时细菌性斑点明显增加(→);c) 齿肋赤藓接种病原菌11 d时叶片褪绿(→);d) 齿肋赤藓接种病原菌11 d时茎秆褐化(→);e) 银叶真藓对照组;f) 银叶真藓接种病原菌11 d时茎秆褐化(→);g) 小立碗藓对照组;h) 小立碗藓接种病原菌11 d时配子体状况(→)。Figure 2. Representation of gametophytes of three mosses infected with Pst DC3000 (scale bar=200 μm)Note:a) control group of S. caninervis; b) the bacterial spots increased obviously 7 days after inoculation (→); c) the leaves of S. caninervis chlorosis after inoculation with the pathogen for 11 days (→); d) the browning of the stem of S. caninervis when inoculated with the pathogen for 11 days (→); e) control group of B. argenteum; f) the stem of B. argenteum browning when inoculated with the pathogen for 11 days (→); g) control group of P. patens; h) the state of P. patens gametophyte when P. patens was inoculated with pathogen for 11 days (→).
图 2 Pst DC3000侵染3种苔藓配子体的表征(比例尺=200 μm)注:a) 齿肋赤藓对照组;b) 齿肋赤藓接种病原菌7 d时细菌性斑点明显增加(→);c) 齿肋赤藓接种病原菌11 d时叶片褪绿(→);d) 齿肋赤藓接种病原菌11 d时茎秆褐化(→);e) 银叶真藓对照组;f) 银叶真藓接种病原菌11 d时茎秆褐化(→);g) 小立碗藓对照组;h) 小立碗藓接种病原菌11 d时配子体状况(→)。Figure 2. Representation of gametophytes of three mosses infected with Pst DC3000 (scale bar=200 μm)Note:a) control group of S. caninervis; b) the bacterial spots increased obviously 7 days after inoculation (→); c) the leaves of S. caninervis chlorosis after inoculation with the pathogen for 11 days (→); d) the browning of the stem of S. caninervis when inoculated with the pathogen for 11 days (→); e) control group of B. argenteum; f) the stem of B. argenteum browning when inoculated with the pathogen for 11 days (→); g) control group of P. patens; h) the state of P. patens gametophyte when P. patens was inoculated with pathogen for 11 days (→).2.2 细胞活力
不同苔藓在接种Pst DC3000后细胞损伤程度差异较大,具体表现为被伊文思蓝染液处理后苔藓配子体染色面积不同。与接种0 d相比,小立碗藓的染色程度最高,细胞死亡程度严重;银叶真藓适中,细胞死亡多集中在茎秆褐化部位;齿肋赤藓染色多集中于配子体叶片病灶发生部位,叶片褪绿现象发生后扩散至整株配子体(图3)。染色区域多集中在病征明显的部位,这与3种苔藓发病后的表型相吻合。
2.3 H2O2原位染色
接种Pst DC3000后,3种苔藓表面出现H2O2积累的现象,并集中在不同的区域,随着接种时间的增加,染色面积逐渐扩大(图4)。接种14 d时,3种苔藓均有明显的H2O2积累,经酒精煮沸后苔藓配子体呈褪色状态。接种0 d时,小立碗藓经褪色后近乎为透明状态,而侵染后其配子体整株被染为棕褐色,其中茎秆部位为深棕色,说明活性氧积累最多;叶片部位染色较浅,病斑集中的部位为深棕色,说明活性氧积累水平较高。接种14 d时,齿肋赤藓叶片褪色明显,而经DAB染色后,整株为明显的深棕色,说明配子体H2O2整体迸发明显。病原菌侵染下,活性氧积累主要集中于银叶真藓茎秆部位,表现为其茎秆部位被染为深棕色;叶片部位虽有活性氧积累,但较茎秆部位少,颜色较浅。
2.4 超氧阴离子检测
接种Pst DC3000后,3种苔藓表面均出现不同程度的超氧阴离子积累现象(图5)。接种病原菌后,银叶真藓超氧阴离子最先在配子体下端积累;随着接种时间的增加,超氧阴离子从根部向上扩散,多集中在配子体茎秆褐化部位。齿肋赤藓的超氧阴离子主要集中在叶片,随着接种时间的增加,超氧阴离子积累的部位扩散至整株配子体。随着接种时间的增加,小立碗藓配子体超氧阴离子含量逐渐上升,接种病原菌11 d时整株配子体有明显的超氧阴离子积累,接种14 d时超氧阴离子积累最为明显,茎秆染色部位较11 d时面积扩大。
2.5 q-PCR结果
由图6可知:接种病原菌3 d时苔藓内已检测到病原菌DNA的表达,但其表达量较低;随着接种时间的增加,Pst DC3000在3种苔藓中的数量明显增加,接种7 d时约为1×105 copies/μL;接种15 d时,小立碗藓中的病原菌数量显著高于齿肋赤藓和银叶真藓(P<0.05)。
![]() 图 6 Pst DC3000侵染3种苔藓后病原菌数量的变化注:不同小写字母表示相同接种时间不同苔藓间病原菌数量显著差异 (P<0.05)。Figure 6. Changes of pathogenic number in gametophytes of three mosses infected with Pst DC3000Note:Different lowercase letters indicate significant differences in pathogen number among different mosses under the same infection time (P<0.05).
图 6 Pst DC3000侵染3种苔藓后病原菌数量的变化注:不同小写字母表示相同接种时间不同苔藓间病原菌数量显著差异 (P<0.05)。Figure 6. Changes of pathogenic number in gametophytes of three mosses infected with Pst DC3000Note:Different lowercase letters indicate significant differences in pathogen number among different mosses under the same infection time (P<0.05).3. 讨论
荒漠耐干苔藓是荒漠生态系统中不可或缺的部分,但在野外和组培过程中时常有苔藓感病现象的发生。关于苔藓与病原菌互作的报道较少。前人研究表明:革兰氏阴性菌胡萝卜欧文软腐病菌(Erwinia carotovora)和灰霉菌(Botrytis cinerea)能够侵染小立碗藓,导致其组织发生褐变,这两类病原菌能够侵染并诱导植物发生防御反应,最终造成小立碗藓配子体死亡[25],但关于齿肋赤藓和银叶真藓与病原菌间互作的研究却鲜有报道。
丁香假单胞菌是世界范围内普遍存在的细菌,目前已知可对番茄、辣椒和拟南芥等植物造成损伤。TAO等[26]研究表明:Pst DC3000侵染植物后会出现细菌性斑点,叶片组织出现广泛的黄化现象,随着接种时间的增加出现局部坏死的症状。本研究表明:接种病原菌3 d时,观察到Pst DC3000侵染植物后的典型表征,即叶片出现细菌性病斑以及叶片和茎秆褐化,且伴有褪绿晕的出现;接种后期3种苔藓配子体茎秆的褐化现象严重,同时齿肋赤藓和小立碗藓伴有叶片泛黄的现象,随着接种时间的增加,病原菌在植株体内大量积累,苔藓配子体发生免疫反应,产生明显的病灶,苔藓配子体部分坏死,这一结果与KATAGIRI等[27]的报道相似。根据NOMURA等[28]对Pst DC3000入侵机制的研究,推测该种表型产生的原因可能是接种Pst DC3000后,病原菌侵入到苔藓中,利用其配子体内的营养物质繁殖,产生各种毒素,破坏其光合作用,配子体叶片褪绿,并伴有病斑和坏死现象。本研究表明:接种Pst DC3000后,苔藓会产生典型的病害反应,可以观察到病原菌入侵后的表型。
本研究表明:随着接种时间的增加,苔藓配子体染色面积逐渐增大,说明接种病原菌对3种苔藓造成了不可逆的损伤,染色区域多集中在坏死部位。齿肋赤藓的芒尖属于无生物活性结构,能够被伊文思蓝整体染为蓝色,配子体病斑发生处以及褐化严重的部位也被染为蓝色;银叶真藓发病的主要表现为茎秆褐化,发病部位染色较为集中;被病原菌侵染后的小立碗藓除茎秆褐化外,发病程度较重的则会整株萎蔫坏死,蓝色区域也从部分扩散到整株配子体,这与ZHANG等[29]的报道一致。随着接种时间的增加,3种苔藓配子体被伊文思染色的面积逐渐扩大,说明病原菌侵染3种苔藓后对其造成了明显的损伤,坏死部位细胞死亡明显。
病原菌在植物体内定植后会引起活性氧(reactive oxygen species,ROS)的积累,这也是植物防御反应的典型表现[30]。ROS积累包括H2O2的产生以及超氧阴离子的累积,当病原菌入侵到植物体内时,植物为了抵御病原菌的入侵会产生H2O2清除病原菌,随着病原菌的大量繁殖,活性氧族的代谢明显紊乱,导致大量H2O2以及超氧阴离子积累,进一步造成植物细胞发生持续性的超敏反应,导致细胞程序性死亡[31]。已有研究表明:DAB可以与H2O2反应产生黄褐色沉淀,这一特性可以用于检测H2O2的存在以及分布情况[32];而超氧阴离子能够将NBT氧化并形成蓝色沉淀,可以用于检测超氧阴离子的存在及分布情况[33]。本研究表明:随着接种时间的增加,3种苔藓的H2O2和超氧阴离子含量逐渐增加,其中小立碗藓和齿肋赤藓的ROS积累多集中在茎秆和叶片病斑处,且以茎秆部位ROS损伤最明显;而银叶真藓的ROS损伤主要集中在茎秆部位。通过观察可知:接种Pst DC3000后3种苔藓有明显的H2O2和超氧阴离子产生,说明病原菌的入侵激活了苔藓的免疫反应;随着接种时间的增加,苔藓的免疫系统发生紊乱,导致ROS大量累积,从而对配子体造成不可逆的损伤。通过荧光定量PCR技术对病原菌在3种苔藓中定植的情况进行实时检测,从感染植物提取的总DNA中特异性扩增出Pst DC3000的DNA,进一步转化为病原菌拷贝数,结果表明:病原菌在接种3 d时已经在苔藓中进行繁殖,病原菌数量随着接种时间的增加而增加。综合病害指标检测表明:随着接种时间的增加,Pst DC3000对3种苔藓的损伤增大。但3种苔藓配子体彼此感病程度差异较大,小立碗藓配子体ROS积累最多,而2种荒漠耐干苔藓相对较少,这可能是因为小立碗藓是耐干敏感型物种,常生活在潮湿、阴蔽的环境中,对周围环境较为敏感,抵抗逆境胁迫的水平较低[34];而荒漠耐干苔藓齿肋赤藓叶片顶端具芒尖[35],叶片被蜡质结构包裹[36],对病原菌侵入起到一定的抵抗作用。此外,推测齿肋赤藓配子体内可能存在较为丰富的抗病相关基因,并且在病原菌入侵后基因获得高表达,进而表现出一定程度的抗病性,具体机制有待于进一步研究。
4. 结论
丁香假单胞菌能够侵染2种耐干苔藓及1种苔藓模式种,接种后表现为茎秆褐化,叶片出现细菌性斑点和褪绿晕。发病后的苔藓能够检测到细胞死亡,同时在病害发生的区域可以检测到H2O2和超氧阴离子积累;病原菌在苔藓内的数量随接种时间的增加而增加。本研究为后续苔藓与病原菌间的互作研究提供了一定的理论基础。
-
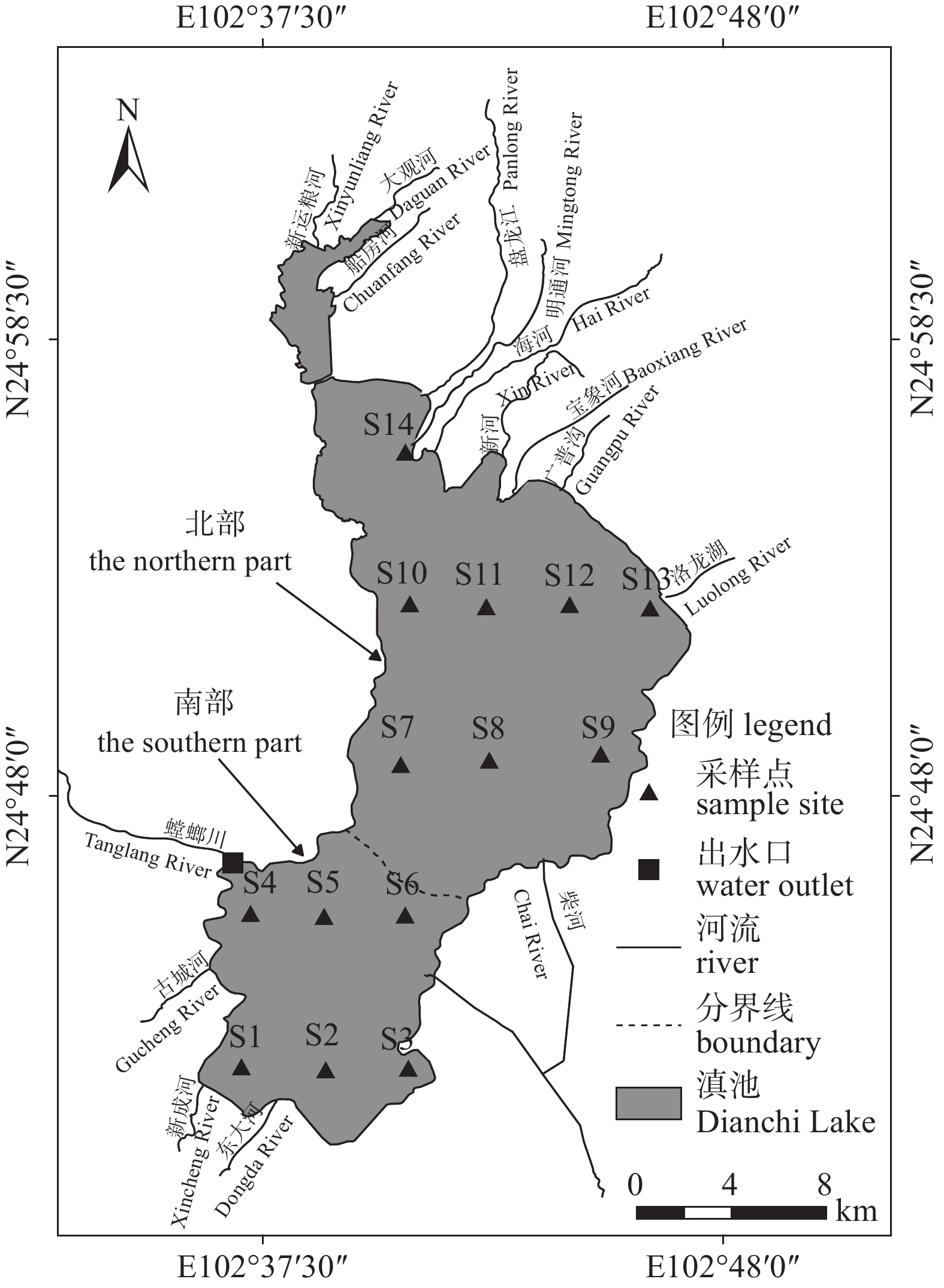
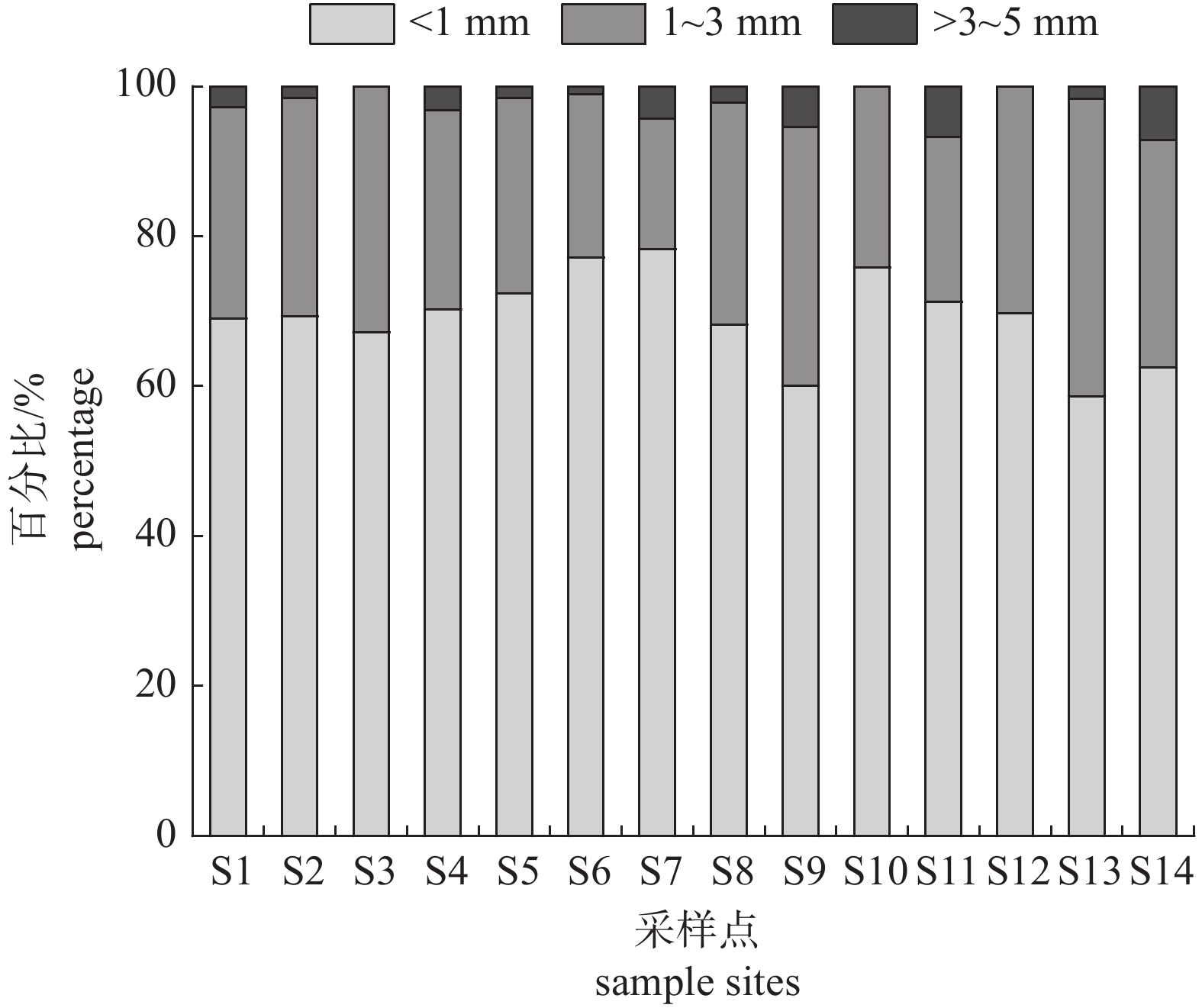
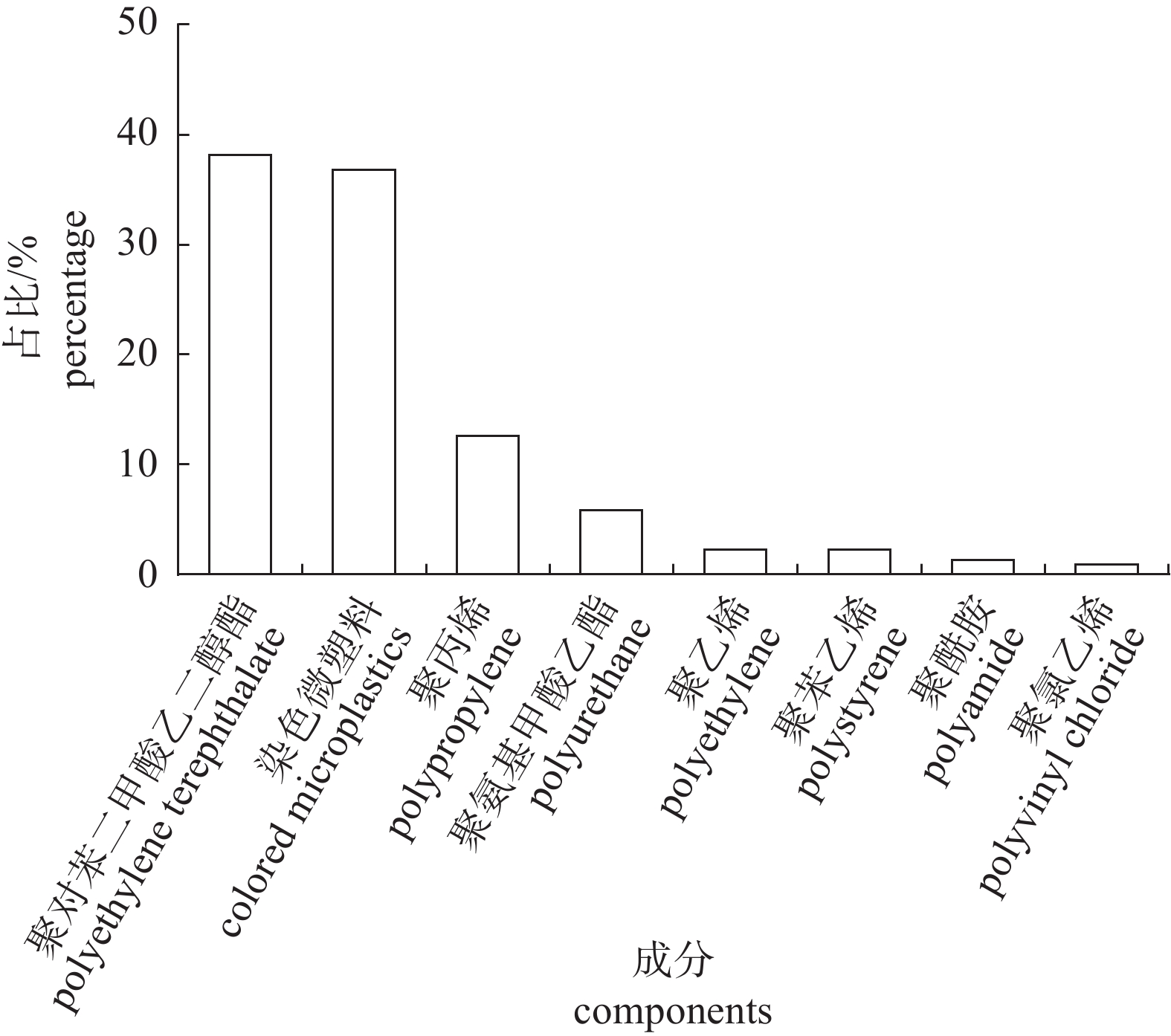
表 1 滇池各采样点坐标、海拔及水深
Table 1 The coordinates, altitude and water depth of the Dianchi Lake sample sites
采样点
sample sites经度
longitude纬度
latitude海拔/m
altitude水深/m
water depthS1 102°37′04.25″ 24°41′48.89″ 1883.1 2.45 S2 102°38′56.31″ 24°41′43.95″ 1882.8 2.74 S3 102°40′48.36″ 24°41′45.60″ 1884.2 1.12 S4 102°37′58.63″ 24°45′21.47″ 1882.2 3.53 S5 102°38′53.01″ 24°45′19.82″ 1881.6 3.58 S6 102°40′43.00″ 24°45′11.00″ 1882.8 2.50 S7 102°40′45.07″ 24°48′52.40″ 1881.4 4.25 S8 102°42′38.71″ 24°48′49.10″ 1880.6 4.50 S9 102°44′35.71″ 24°48′42.51″ 1881.2 4.42 S10 102°40′50.01″ 24°52′20.03″ 1881.8 3.75 S11 102°42′36.00″ 24°52′24.37″ 1881.4 4.21 S12 102°44′29.73″ 24°52′24.38″ 1881.5 4.06 S13 102°46′21.23″ 24°52′21.68″ 1883.3 2.40 S14 102°40′43.42″ 24°55′55.91″ 1884.2 1.60 -
[1] 孟坤. 2021—2022年世界塑料工业进展(Ⅰ): 通用塑料[J]. 塑料工业, 2023, 51(3): 1. DOI: 10.3969/j.issn.1005-5770.2023.03.001. [2] THOMPSON R C, OLSEN Y, MITCHELL R P, et al. Lost at sea: where is all the plastic?[J]. Science, 2004, 304(5672): 838. DOI: 10.1126/science.1094559.
[3] ORY N C, GALLARDO C, LEN M, et al. Capture, swallowing, and egestion of microplastics by a planktivorous juvenile fish[J]. Environmental Pollution, 2018, 240: 566. DOI: 10.1016/j.envpol.2018.04.093.
[4] DANIEL D B, ASHRAF P M, THOMAS S N. Abundance, characteristics and seasonal variation of microplastics in Indian white shrimps (Fenneropenaeus indicus) from coastal waters off Cochin, Kerala, India[J]. Science of the Total Environment, 2020, 737: 139839. DOI: 10.1016/j.scitotenv.2020.139839.
[5] ZHANG R, WANG M, CHEN X P, et al. Combined toxicity of microplastics and cadmium on the zebrafish embryos (Danio rerio)[J]. Science of the Total Environment, 2020, 743: 140638. DOI: 10.1016/j.scitotenv.2020.140638.
[6] 丁剑楠, 张闪闪, 邹华, 等. 淡水环境中微塑料的赋存、来源和生态毒理效应研究进展[J]. 生态环境学报, 2017, 26(9): 1619. DOI: 10.16258/j.cnki.1674-5906.2017.09.023. [7] BELONTZ S L, CORCORAN P L, DE HAAN-WARD J, et al. Factors driving the spatial distribution of microplastics in nearshore and offshore sediment of Lake Huron, North America[J]. Marine Pollution Bulletin, 2022, 179: 113709. DOI: 10.1016/j.marpolbul.2022.113709.
[8] LENAKER P L, CORSI S R, MASON S A. Spatial distribution of microplastics in surficial benthic sediment of Lake Michigan and Lake Erie[J]. Environmental Science & Technology, 2021, 55(1): 373. DOI: 10.1021/acs.est.0c06087.
[9] FISCHER E K, PAGLIALONGA L, CZECH E, et al. Microplastic pollution in lakes and lake shoreline sediments: a case study on Lake Bolsena and Lake Chiusi (central Italy)[J]. Environmental Pollution, 2016, 213: 648. DOI: 10.1016/j.envpol.2016.03.012.
[10] GOPINATH K, SESHACHALAM S, NEELAVANNAN K, et al. Quantification of microplastic in Red Hills Lake of Chennai City, Tamil Nadu, India[J]. Environmental Science and Pollution Research, 2020, 27(26): 33297. DOI: 10.1007/s11356-020-09622-2.
[11] YUAN W K, LIU X Y, WANG W F, et al. Microplastic abundance, distribution and composition in water, sediments, and wild fish from Poyang Lake, China[J]. Ecotoxicology and Environmental Safety, 2019, 170: 180. DOI: 10.1016/j.ecoenv.2018.11.126.
[12] YIN L S, WEN X F, DU C Y, et al. Comparison of the abundance of microplastics between rural and urban areas: a case study from East Dongting Lake[J]. Chemosphere, 2019, 244: 125486. DOI: 10.1016/j.chemosphere.2019.125486.
[13] ZHANG Q J, LIU T, LIU L, et al. Distribution and sedimentation of microplastics in Taihu Lake[J]. Science of the Total Environment, 2021, 795: 148745. DOI: 10.1016/j.scitotenv.2021.148745.
[14] XIONG X, ZHANG K, CHEN X C, et al. Sources and distribution of microplastics in China’s largest inland lake: Qinghai Lake[J]. Environmental Pollution, 2018, 235: 899. DOI: 10.1016/j.envpol.2017.12.081.
[15] CERA A, PIERDOMENICO M, SODO A, et al. Spatial distribution of microplastics in volcanic lake water and sediments: relationships with depth and sediment grain size[J]. Science of the Total Environment, 2022, 829: 154659. DOI: 10.1016/j.scitotenv.2022.154659.
[16] WEN X F, DU C Y, XU P, et al. Microplastic pollution in surface sediments of urban water areas in Changsha, China: abundance, composition, surface textures[J]. Marine Pollution Bulletin, 2018, 136: 414. DOI: 10.1016/j.marpolbul.2018.09.043.
[17] YANG S Y, ZHOU M, CHEN X, et al. A comparative review of microplastics in lake systems from different countries and regions[J]. Chemosphere, 2022, 286: 131806. DOI: 10.1016/j.chemosphere.2021.131806.
[18] NEELAVANNAN K, SEN I S, LONE A M, et al. Microplastics in the high-altitude Himalayas: assessment of microplastic contamination in freshwater lake sediments, Northwest Himalaya (India)[J]. Chemosphere, 2022, 290: 133354. DOI: 10.1016/j.chemosphere.2021.133354.
[19] ONI B A, AYENI A O, AGBOOLA O, et al. Comparing microplastics contaminants in (dry and raining) seasons for Ox-Bow Lake in Yenagoa, Nigeria[J]. Ecotoxicology and Environmental Safety, 2020, 198: 110656. DOI: 10.1016/j.ecoenv.2020.110656.
[20] HU D F, ZHANG Y X, SHEN M C. Investigation on microplastic pollution of Dongting Lake and its affiliated rivers[J]. Marine Pollution Bulletin, 2020, 160: 111555. DOI: 10.1016/j.marpolbul.2020.111555.
[21] 王璇, 牛司平, 宋小龙, 等. 城市湖泊沉积物微塑料污染特征[J]. 环境科学, 2020, 41(7): 3240. DOI: 10.13227/j.hjkx.201912076. [22] BALLENT A, CORCORAN P L, MADDEN O, et al. Sources and sinks of microplastics in Canadian Lake Ontario nearshore, tributary and beach sediments[J]. Marine Pollution Bulletin, 2016, 110(1): 383. DOI: 10.1016/j.marpolbul.2016.06.037.
[23] 袁海英, 侯磊, 梁启斌, 等. 滇池近岸水体微塑料污染与富营养化的相关性[J]. 环境科学, 2021, 42(7): 3166. DOI: 10.13227/j.hjkx.202012100. [24] 李大凤, 邓春暖, 张权, 等. 滇池水体中纤维状微塑料的污染特征及其来源分析[J]. 湿地科学, 2022, 20(4): 529. DOI: 10.13248/j.cnki.wetlandsci.2022.04.009. [25] DENG C N, LI D F, LI J, et al. Impacts of underwater topography on the distribution of microplastics in lakes: a case from Dianchi Lake, China[J]. Science of the Total Environment, 2022, 837: 155708. DOI: 10.1016/j.scitotenv.2022.155708.
[26] 刘瑞华, 曹暄林. 滇池20年污染治理实践与探索[J]. 环境科学导刊, 2017, 36(6): 31. DOI: 10.13623/j.cnki.hkdk.2017.06.007. [27] 贺克雕. 滇池水质状况综合评价及变化趋势分析[J]. 人民长江, 2012, 43(12): 37. DOI: 10.16232/j.cnki.1001-4179.2012.12.009. [28] 马巍, 浦承松, 罗佳翠, 等. 滇池水动力特性及其对北岸蓝藻堆积驱动影响[J]. 水利学报, 2013, 44(S1): 22. DOI: 10.13243/j.cnki.slxb.2013.s1.024. [29] 万顺, 徐国策, 李清顺, 等. 大理河流域微塑料空间分布及其来源[J]. 环境科学学报, 2022, 42(8): 293. DOI: 10.13671/j.hjkxxb.2021.0590. [30] JIANG C B, YIN L S, WEN X F, et al. Microplastics in sediment and surface water of west Dongting Lake and south Dongting Lake: abundance, source and composition[J]. International Journal of Environmental Research and Public Health, 2018, 15(10): 2164. DOI: 10.3390/ijerph15102164.
[31] MAO R F, SONG J L, YAN P C, et al. Horizontal and vertical distribution of microplastics in the Wuliangsuhai Lake sediment, northern China[J]. Science of the Total Environment, 2021, 754: 142426. DOI: 10.1016/j.scitotenv.2020.142426.
[32] IRFAN T, KHALID S, TANEEZ M, et al. Plastic driven pollution in Pakistan: the first evidence of environmental exposure to microplastic in sediments and water of Rawal Lake[J]. Environmental Science and Pollution Research, 2020, 27(13): 15083. DOI: 10.1007/s11356-020-07833-1.
[33] 陈春瑜, 杨艳, 范红梅, 等. 城市黑臭水体治理思路初探: 以昆明市滇池流域为例[J]. 环境科学导刊, 2020, 39(5): 38. DOI: 10.13623/j.cnki.hkdk.2020.05.006. [34] ATHEY S N, ADAMS J K, ERDLE L M, et al. The widespread environmental footprint of indigo denim microfibers from blue jeans[J]. Environmental Science and Technology, 2020, 7(11): 840. DOI: 10.1021/acs.estlett.0c00498.
[35] LUO Y L, GIBSON C T, TANG Y H, et al. Characterising microplastics in shower wastewater with Raman imaging[J]. Science of the Total Environment, 2022, 811: 152409. DOI: 10.1016/j.scitotenv.2021.152409.
[36] ENDERS K, LENZ R, STEDMON C A, et al. Abundance, size and polymer composition of marine microplastics ≥10 μm in the Atlantic Ocean and their modelled vertical distribution[J]. Marine Pollution Bulletin, 2015, 100(1): 70. DOI: 10.1016/j.marpolbul.2015.09.027.
[37] 张权, 邓春暖, 郭锋锋, 等. 滇池南部沿岸滩涂塑料污染特征研究[J]. 宜春学院学报, 2020, 42(12): 17. [38] 张浩. 滇池表层沉积物微塑料赋存特征及影响因素[D]. 昆明: 云南师范大学, 2022. [39] 时馨竹, 孙丽娜, 李珍, 等. 沈阳周边农田土壤中微塑料组成与分布[J]. 农业环境科学学报, 2021, 40(7): 1498. DOI: 10.11654/jaes.2021-0006. [40] SUN Q, REN S Y, NI H G. Incidence of microplastics in personal care products: an appreciable part of plastic pollution[J]. Science of the Total Environment, 2020, 742: 140218. DOI: 10.1016/j.scitotenv.2020.140218.
[41] BERTOLDI C, LARA L Z, MIZUSHIMA F A D L, et al. First evidence of microplastic contamination in the freshwater of Lake Guaíba, Porto Alegre, Brazil[J]. Science of the Total Environment, 2020, 759: 143503. DOI: 10.1016/j.scitotenv.2020.143503.
[42] LIANG T, LEI Z Y, FUAD M T I, et al. Distribution and potential sources of microplastics in sediments in remote lakes of Tibet, China[J]. Science of the Total Environment, 2022, 806: 150526. DOI: 10.1016/j.scitotenv.2021.150526.
[43] 姚明轩, 白雪, 徐振佳, 等. 骆马湖表层沉积物微塑料的分布、来源及储存量[J]. 环境科学, 2022, 43(5): 2566. DOI: 10.13227/j.hjkx.202108270. [44] TANG N, YU Y J, CAI L Q, et al. Distribution characteristics and source analysis of microplastics in urban freshwater lakes: a case study in Songshan Lake of Dongguan, China[J]. Water, 2022, 14(7): 1111. DOI: 10.3390/w14071111.
[45] 罗建宁, 肖永林, 苏俊周, 等. 昆明滇池水动力条件与沉积物特征[J]. 中国地质科学院成都地质矿产研究所所刊, 1987(8): 89. [46] FREE C M, JENSEN O P, MASON S A, et al. High-levels of microplastic pollution in a large, remote, mountain lake[J]. Marine Pollution Bulletin, 2014, 85: 156. DOI: 10.1016/j.marpolbul.2014.06.001.




 下载:
下载: