青稞遗传多样性及其农艺性状与SSR标记的关联分析
-
关键词:
- 青稞 /
- 简单序列重复(SSR) /
- 遗传多样性分析 /
- 农艺性状 /
- 关联分析
Genetic Diversity and Association Analysis of Agronomic Traits with SSR Markers in Hulless Barley
-
近年来,苹果在全球范围内的产销量居高不下,中国苹果的产量也在快速增长[1]。苹果中含有丰富的维生素、有机酸、多酚、黄酮、多糖、微量元素和矿物质,是日常生活中不可缺少的水果之一[2]。目前,市面上的苹果产品主要是苹果醋、苹果汁和苹果干等,不能满足人们快节奏生活对新鲜苹果的需求。将苹果制成鲜切片不仅能满足现代人快节奏的生活,还能增加产品的种类和附加值,延伸苹果的产业链。然而,苹果鲜切片在贮藏过程中易受微生物的污染,使其品质下降,进而引发食品安全危机,危害人体健康。为解决这一问题,水果鲜切片常用食品添加剂[3-6]和低温冷藏[7]的方式处理,但不可避免地对水果风味造成一定影响或贮藏时间达不到预期效果,因此,亟需开发一种不影响水果品质的贮藏技术。
微酸性电解水(slightly acidic electrolyzed water,SAEW)是一种由稀盐酸电解而成、无色无臭的氧化还原产物,pH值为5.0~6.5[8],其有效氯的杀菌能力是相同浓度下次氯酸根离子的80~150倍[9]。日本厚生劳动省和美国食品药品监督管理局已允许SAEW作为食品添加剂中的消毒剂[10-11]。目前,国内外关于SAEW在食品领域的研究主要集中在食品保鲜[12]和杀菌消毒[13]等方面,近年来SAEW常被用于去除果蔬表面的微生物,保持食品贮藏期间的品质[14-20]。食品加工行业杀菌的方式多采用热杀菌,但高温会使食品中的营养成分流失,相较而言,中温对食品的损害较小,但目前鲜有关于中温SAEW并联技术对鲜切水果贮藏品质影响的报道。本研究以云南昭通苹果为材料,探究中温SAEW并联加工对控制苹果鲜切片表面微生物的污染及其贮藏过程中品质参数的影响,研究结果可为控制鲜切品表面微生物及改善水果贮藏品质提供一定的理论依据。
1. 材料与方法
1.1 材料与试剂
供试苹果购自农贸市场,选取果实成熟度一致、大小相同且无机械损伤和病虫害的新鲜昭通苹果,经去皮、去核后切成2 cm×2 cm×1 cm的匀块状鲜切片。
碘化钾、可溶性淀粉、36%~38%盐酸和草酸均为分析纯,购自天津风船化学试剂科技有限公司;抗坏血酸和碘均为分析纯,购自上海试四赫维化工有限公司;氯化钠为分析纯,购自天津市鼎盛鑫化工有限公司;2,6-二氯靛酚为分析纯,购自天津恒兴试剂公司;结晶紫中性红胆盐琼脂(VRBA),购自广东环凯微生物科技有限公司;马铃薯葡萄糖琼脂(PDA),购自海盛思生化科技有限公司;无水乙醇为分析纯,购自天津市富宇精细化工有限公司。
1.2 仪器与设备
HD-240L 型水神微酸性次氯酸发生器,上海旺旺集团;HH-8数显恒温水浴锅,国华电器有限公司;GY-1水果硬度计,浙江托普仪器有限公司;DHP-9082B恒温培养箱,上海博迅实业有限公司医疗设备厂;LDZM-60KCS立式压力蒸汽灭菌器,上海申安医疗器械厂;JJCJ-CJ-1FD超洁净工作台,苏州市金净净化设备科技有限公司。
1.3 试验方法
1.3.1 SAEW的制备及其理化特性参数的测定
SAEW以自来水为原水,辅以6%稀盐酸,用水神微酸性次氯酸水发生器电解生成,采集设备电流运行稳定后的SAEW用于试验。采用碘量法[21]对SAEW的有效氯质量浓度(available chlorine mass concentration,ACC)进行测定。
1.3.2 菌种的活化及苹果鲜切片接种
用接种环取1环保藏在培养基内的菌液接种到灭菌冷却后的肉汤培养基中,将其放置于恒温振荡器中,在37 ℃条件下培养24 h得到活化的菌悬液。选取大小一致的苹果鲜切片放置于超净操作台,用移液枪吸取上述菌悬液1 mL,均匀滴加到苹果鲜切片表面,接种量为106.54 CFU/g,接种后的苹果鲜切片在超净工作台放置20 min。
1.3.3 苹果鲜切片的杀菌处理及菌落总数测定
在一定条件下,分别选取不同ACC、料液比、浸泡时间和处理温度进行单因素试验。在25 ℃、30 mg/L ACC、浸泡5 min条件下,以不同料液比(1∶5、1∶10、1∶15和1∶20,g∶mL)进行处理;在25 ℃、30 mg/L ACC、料液比1∶10 (g∶mL)条件下,以不同浸泡时间(3、6、9和12 min) 进行处理;在30 mg/L ACC、料液比1∶10 (g∶mL)、浸泡5 min条件下,以不同温度(25、35、45和55 ℃)进行处理;在25 ℃、料液比1∶10 (g∶mL)、浸泡5 min条件下,以不同ACC (10、20、30和40 mg/L) 进行处理。按以上条件分别处理苹果鲜切片并测定表面菌落总数,以无菌水处理为对照,每个处理重复3次。
1.3.4 Box-Behnken响应面试验设计
根据单因素试验结果,选取处理温度(A)、浸泡时间(B)、料液比(C)和ACC (D)为主要影响因素(表1),以菌落总数死亡数量级Y为响应值,使用Box-Benhnken进行优化并得到最佳条件。
表 1 试验因素水平及编码Table 1. Test factor level and coding因素
factor水平 level −1 0 1 A:处理温度/℃ temperature 25 35 45 B:浸泡时间/min soak time 3 6 9 C:料液比 (g∶mL) ratio of solid to liquid 1∶5 1∶10 1∶15 D:有效氯质量浓度/(mg·L−1)
available chlorine mass concentration (ACC)10 20 30 1.3.5 苹果鲜切片贮藏品质的测定
利用优化后的最佳处理条件对苹果鲜切片进行处理,再将其分装于无菌聚乙烯塑料薄膜中并密封,置于4 ℃冰箱贮藏12 d,每隔2 d测定1次菌落总数、硬度、维生素C含量、亮度和失重率,以确定中温SAEW并联加工对苹果鲜切片贮藏品质的影响。每个指标每次重复测定3次,并以无菌水处理作为对照。
(1) 菌落总数:测定和计数均参照 GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[22] ,结果用lg(CFU/g)表示,菌落总数死亡数量级(Y)的计算公式为:
$$ Y={\rm{lg}}\left(\frac{{N}_{0}}{N}\right) 。 $$ 式中:N0为处理前样品表面菌落总数,N为处理后样品表面菌落总数。
(2) 硬度:用GY-1水果硬度计测量。测量前调节硬度计,使驱动指针与表盘的刻度线“2”对齐。 测量时均匀用力使指针垂直于苹果鲜切片表面,匀速压入苹果中,当压头的刻度线正好全部没入苹果鲜切片时停止。此时得到的读数即水果的硬度,重复测量3次。
(3) 失重率:采用称量法测定,并按照公式计算。失重率=(贮藏前质量−贮藏后质量)/贮藏前质量×100%。
(4) 亮度:用色差仪定期测定苹果鲜切片表面,结果以亮度(L*)表示[23]。
(5) 维生素C含量:采用2,6-二氯靛酚滴定法[24]测定,并按照公式计算:
$$ X=\frac{(V-{V}_{0})\times T\times A}{m}\times 100 。 $$ 式中:X为维生素C含量,mg/100 g;V为滴定苹果鲜切片滤液所消耗的2,6-二氯靛酚溶液体积,mL;V0为滴定空白所消耗的2,6-二氯靛酚溶液体积,mL;T为每毫升2,6-二氯靛酚溶液相当于维生素C的毫克数,mg/mL;A为稀释倍数;m为试样质量,g。
1.4 数据统计与分析
使用Design-Expert优化最佳处理条件;使用Excel软件进行数据处理;使用Origin软件绘图;使用SPSS进行显著性分析,显著性水平取P=0.05。
2. 结果与分析
2.1 单因素试验
2.1.1 料液比对表面菌落总数的影响
由图1可知:鲜切苹果表面菌落总数的死亡数量级随料液比的增加而增加,样品经料液比1∶5、1∶10、1∶15和1∶20 (g∶mL)浸泡处理5 min后,表面菌落总数的死亡数量级分别增加至1.76、2.15、2.19和2.24。显著性分析表明:当料液比达到1∶10后,菌落总数死亡数量级无显著性差异(P>0.05),根据最小剂量最低成本达到最优效果原则,选择料液比1∶10 (g∶mL)为响应面试验的零水平。
2.1.2 处理时间对表面菌落总数的影响
由图2可知:苹果鲜切片表面的菌落总数死亡数量级随着处理时间的增加而逐渐增加。在3~6 min内,菌落总数死亡数量级由1.07 增加至1.51,且有显著性差异(P<0.05),而6~12 min内菌落总数死亡数量级无显著性差异(P>0.05)。综合考虑,选择处理时间6 min 为宜。
2.1.3 处理温度对表面菌落总数的影响
由图3可知:随着处理温度的升高,苹果鲜切片表面菌落总数死亡数量级逐渐增加,样品经25、35、45和55 ℃ 浸泡处理5 min后,表面菌落总数的死亡数量级分别增加至1.48、1.77、1.81和1.88。显著性分析显示:在25~35 ℃之间菌落总数死亡数量级有显著性差异 (P<0.05),在35~45 ℃之间菌落总数死亡数量级无显著性差异(P>0.05)。综合考虑,选择35 ℃为最佳处理温度。
2.1.4 有效氯质量浓度对表面菌落总数的影响
由图4可知:菌落总数死亡数量级随ACC的增加而增加,当ACC 为10~20 mg/L时,菌落总数死亡数量级由1.49增加至1.65,显著性分析表明:苹果鲜切片表面菌落总数死亡数量级有显著性差异(P<0.05);当ACC 为20~40 mg/L时,苹果鲜切片表面菌落总数死亡数量级无显著性差异(P>0.05)。当ACC为 20 mg/L达到最佳处理效果,故选择20 mg/L为最佳ACC。
2.2 响应面优化结果
回归分析得到菌落总数死亡数量级(Y)关于处理温度(A)、浸泡时间(B)、料液比(C)和ACC (D)的二次多元回归方程为:Y=1.57+0.51A+0.18B+0.10C+0.18D−0.07AB−0.15AC+0.13AD+0.11BC−0.13BD+0.04CD−0.28A2−0.05B2−0.08C2−0.02D2。对该回归方程进行方差分析,结果(表2)显示:回归方程的模型项F=16.94,P<0.0001,表明模型极显著;失拟项F=2.68,P=0.1774>0.05,差异不显著,表明残差由随机误差引起;模型的确定系数R2=0.9443,R2adj=0.8885,表明模型的拟合度较好,且误差较小,可以将此模型用于对苹果鲜切片表面菌落总数死亡数量级的分析和预测。
表 2 方差分析Table 2. Variance analysis响应值
response value方差来源
source of variance平方和
quadratic sum自由度
degree of freedom均方
mean squareF值
F-valueP值
P-valueY 模型 model 4.89 14 0.35 16.94 <0.0001** A 3.16 1 3.16 153.26 <0.0001** B 0.39 1 0.39 19.02 0.0007** C 0.12 1 0.12 6.01 0.0279* D 0.39 1 0.39 18.67 0.0007** AB 0.02 1 0.02 0.95 0.3463 AC 0.09 1 0.09 4.22 0.0592 AD 0.07 1 0.07 3.15 0.0976 BC 0.05 1 0.05 2.24 0.1567 BD 0.07 1 0.07 3.53 0.0811 CD 0.01 1 0.01 0.31 0.5864 A2 0.51 1 0.51 24.96 0.0002** B2 0.02 1 0.02 0.72 0.4091 C2 0.04 1 0.04 1.97 0.1818 D2 0.00 1 0.00 0.08 0.7875 残差
residual error0.29 14 0.02 失拟项
misfit term0.25 10 0.03 2.68 0.1774 纯误差
pure error0.04 4 0.01 总和
summation5.18 28 注:“*”表示差异显著;“**”表示差异极显著。
Note: “*” indicates significant differences; “**” indicates extremely significant differences.图5显示:理论最佳处理温度35 ℃、浸泡时间6 min、料液比1∶10 (g∶mL)、ACC 30 mg/L,在此条件下得到菌落总数死亡数量级的理论值为1.82。为确保优化条件的可行性,在此优化条件下对苹果鲜切片进行处理,并进行3次重复验证试验,得到菌落总数死亡数量级的实际值为1.78,与理论值较为吻合,说明可以按该优化条件对苹果鲜切片进行12 d的贮藏试验。
2.3 苹果鲜切片贮藏过程中的样品品质变化
2.3.1 对表面微生物的影响
由图6可知:在贮藏过程中,贮藏时间越长,苹果鲜切片表面菌落总数越多。在0~12 d的贮藏时间内,经中温SAEW并联加工处理的苹果鲜切片表面菌落总数的平均对数值由0.74 增加到2.34,对照组的菌落总数平均对数值由1.25增加到2.47,对照组苹果鲜切片表面菌落总数明显高于中温SAEW并联处理的苹果鲜切片表面菌落总数。
2.3.2 对维生素C含量的影响
由图7可知:对照组和处理组的苹果鲜切片维生素C含量随贮藏时间的增加而逐渐减少。贮藏0~3 d,对照组的维生素C含量高于处理组;贮藏3 d后,同一贮藏时间内处理组的苹果鲜切片维生素C含量均高于对照组,表明处理组维生素C含量的流失速度比对照组缓慢。
2.3.3 对亮度变化的影响
由图8可知:经过中温SAEW并联加工和蒸馏水处理后苹果鲜切片的亮度(L*值)随贮藏时间的延长均呈下降趋势,表明苹果鲜切片的褐变随着贮藏时间的延长而加重。贮藏1~12 d,中温SAEW并联加工的苹果鲜切片L*值的衰减速度明显比对照组缓慢;相同贮藏时间下,中温SAEW并联加工的苹果鲜切片的L*值明显高于对照组L*值。
2.3.4 对硬度的影响
由图9可知:苹果鲜切片的硬度随贮藏时间的增加逐渐下降,但经中温SAEW处理的苹果鲜切片的硬度变化幅度小于对照组。贮藏0~12 d,处理组和对照组的苹果鲜切片硬度分别从8.50 kg/cm2降低至6.50和5.00 kg/cm2;在相同的贮藏时间内,处理组的苹果鲜切片硬度大于对照组,说明SAEW处理能够减缓苹果的软化速度。
2.3.5 对失重率的影响
由图10可知:贮藏期间苹果鲜切片的失重率均逐渐增加,对照组的失重率高于处理组。在相同的贮藏时间,处理组和对照组的失重率数值相近,表明中温SAEW并联处理对苹果鲜切片的质量损失没有显著影响,反而对失重率有一定的缓解作用。
3. 讨论
本研究表明:在有效氯、处理时间及温度一定的条件下,随着料液比的增加,杀菌效果显著,可能是因为随着SAEW用量的增加,使得苹果鲜切片浸泡更加充分,接触面积增大,从而杀菌效果增强。其中,随着ACC的升高,苹果鲜切片表面抑菌效果显著,ACC是抑菌的关键因素,这一结果与赵德锟等[25]对云南鲜切红梨的研究结果一致。有研究表明:在不同料液比条件下,强酸性电解水对微生物的杀菌效果随电解水用量的增加而增强[26],用酸性氧化电位水浸泡鲜参切片,在一定的浸泡时间内杀菌效果显著[27];用微酸性氧化电位水处理金黄色葡萄球菌与大肠杆菌,在一定处理时间范围内,处理时间越长杀菌效果越好[28]。以上规律与本研究结果一致。为探究温度对苹果鲜切片表面菌落总数死亡数量级的影响,本研究选择了不同温度处理苹果鲜切片,结果表明随着温度的升高杀菌效果增强。有研究发现:使用SAEW对微生物进行杀菌时,温度越高杀菌效果越好[29-30],这可能是由于高温使部分微生物失活,从而导致菌落总数死亡数量级增加,但考虑到高温热杀菌会造成苹果鲜切片营养物质流失和感官品质损坏,因此选择35 ℃作为最佳处理温度。
本研究表明:中温SAEW并联加工技术可有效抑制苹果鲜切片表面菌落总数的增长,延缓苹果鲜切片的腐败,这一结果与SAEW处理野生菌[29]、采后西兰花[31]、苹果[32]和宣威火腿贮藏品质的影响结果[33]一致。此外,SAEW处理能减少果蔬中维生素C的流失[34-35],中温SAEW并联加工技术可以延缓苹果鲜切片的褐变速度,与 SAEW能够有效抑制面条和鲜切天麻在储存期间颜色劣变的结果[36-37]相似。中温SAEW并联处理苹果鲜切片后减缓了苹果鲜切片软化的速度,也有研究表明:使用SAEW对蓝莓进行保鲜,其处理组的硬度是对照组的1.42倍[38],分析其原因是SAEW处理可抑制果胶酶的活性,减缓果胶分解,可以达到保持果实硬度的目的。中温SAEW并联处理不会对苹果鲜切片的失重率产生显著影响,这与林永艳[39]对鲜切生菜失重率的研究结果一致。 这些结果表明中温SAEW并联处理能够有效减少果蔬表面的微生物,延缓腐败过程,从而延长贮藏时间和提高贮藏品质,在控制果蔬微生物污染和延长货架期方面具有巨大潜力。
4. 结论
中温SAEW并联的最佳处理条件为:处理温度35 ℃,浸泡时间6 min,料液比1∶10 (g∶mL),有效氯质量浓度30 mg/L。在此条件下,中温SAEW并联对苹果鲜切片表面的微生物有较好的杀菌作用,且在4 d内有良好的抑菌效果。同时,中温SAEW并联处理还可以减缓苹果鲜切片贮藏过程中维生素C含量的流失、褐变速度及软化速度,而对其失重率无显著影响。因此,采用中温SAEW并联对鲜切苹果片进行处理,可有效减少微生物污染,延缓苹果鲜切片腐败,延长其贮藏时间,达到增加货架期的目的。
-
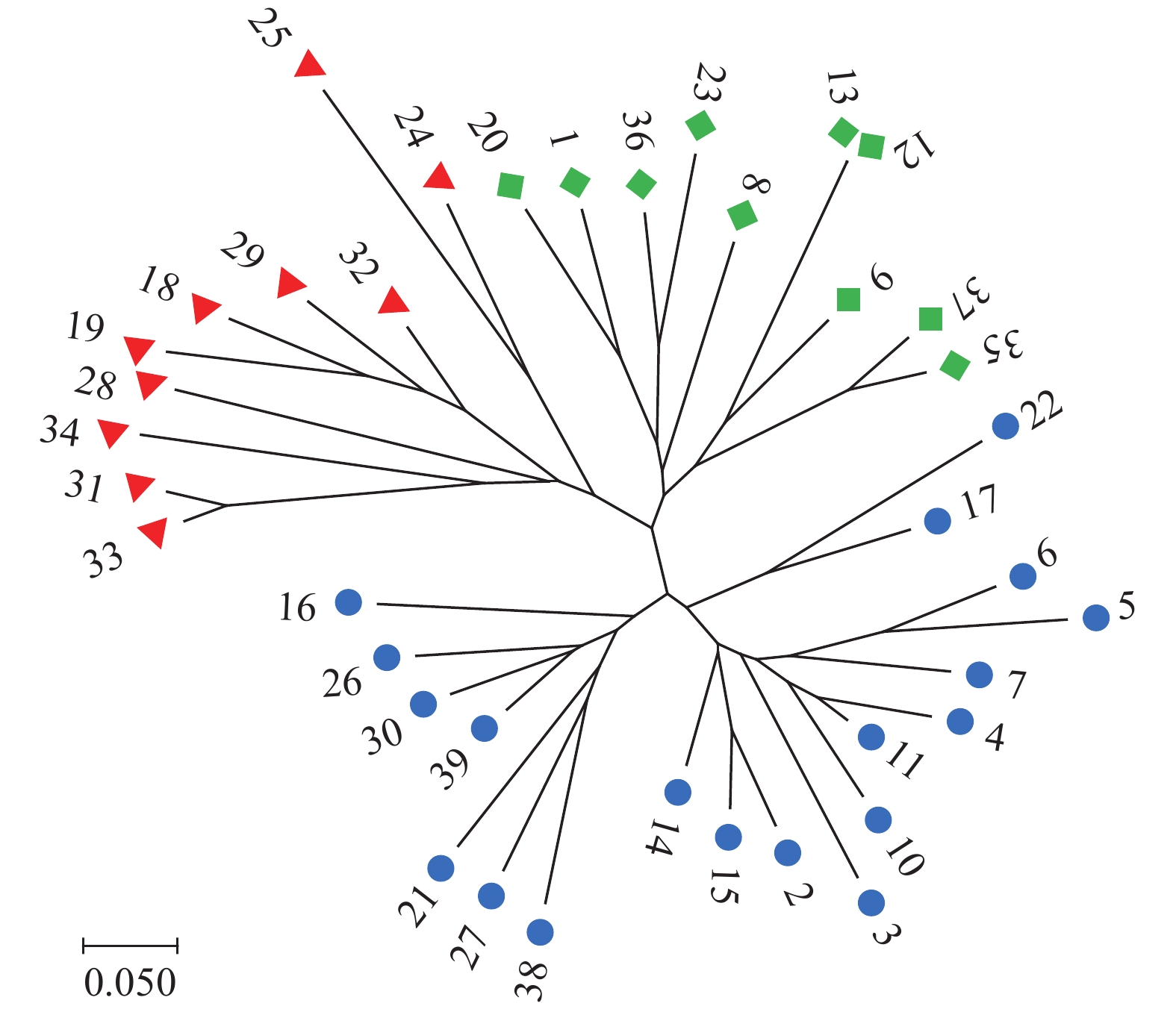
表 1 39份供试青稞亲本材料
Table 1 39 hulless barley parent materials
编号
code材料名称
materials name来源
origin编号
code材料名称
materials name来源
origin1 甘青1号 Ganqing No.1 中国甘肃 Gansu, China 21 藏青2000 Zangqing 2000 中国西藏 Tibet, China 2 甘青2号 Ganqing No.2 中国甘肃 Gansu, China 22 牡丹青稞 Penoy barley 中国甘肃 Gansu, China 3 甘青3号 Ganqing No.3 中国甘肃 Gansu, China 23 新民六棱 Xinmin six rowed barley 中国甘肃 Gansu, China 4 甘青4号 Ganqing No.4 中国甘肃 Gansu, China 24 川83-5319 Chuan 83-5319 中国甘肃 Gansu, China 5 甘青5号 Ganqing No.5 中国甘肃 Gansu, China 25 83A-19-1 中国甘肃 Gansu, China 6 甘青6号 Ganqing No.6 中国甘肃 Gansu, China 26 六棱青稞 Six rowed barley 中国甘肃 Gansu, China 7 甘青7号 Ganqing No.7 中国甘肃 Gansu, China 27 六棱黑青稞 Six rowed black barley 中国甘肃 Gansu, China 8 甘青8号 Ganqing No.8 中国甘肃 Gansu, China 28 13-5171-7 中国西藏 Tibet, China 9 甘青9号 Ganqing No.9 中国甘肃 Gansu, China 29 14-3492 中国西藏 Tibet, China 10 0033-1 中国甘肃 Gansu, China 30 QK03-08 中国四川 Sichuan, China 11 0349 中国甘肃 Gansu, China 31 04-2894-1 中国西藏 Tibet, China 12 黄青1号 Huangqing No.1 中国甘肃 Gansu, China 32 09-5024-13 中国西藏 Tibet, China 13 黄青2号 Huangqing No.2 中国甘肃 Gansu, China 33 西芷12-10556 Xizhi 12-10556 中国西藏 Tibet, China 14 肚里黄 Dulihuang 中国甘肃 Gansu, China 34 西芷13-6927 Xizhi 13-6927 中国西藏 Tibet, China 15 康青3号 Kangqing No.3 中国四川 Sichuan, China 35 昆仑14 Kunlun 14 中国青海 Qinhai, China 16 康青6号 Kangqing No.6 中国四川 Sichuan, China 36 昆仑15 Kunlun 15 中国青海 Qinhai, China 17 碌曲柴青稞 Luquchai barley 中国甘肃 Gansu, China 37 青海2010-7-1 Qinghai 2010-7-1 中国青海 Qinhai, China 18 藏青25 Zangqing 25 中国西藏 Tibet, China 38 ZDM1596 中国青海 Qinhai, China 19 藏青148 Zangqing 148 中国西藏 Tibet, China 39 ZDM820415 中国青海 Qinhai, China 20 藏青320 Zangqing 320 中国西藏 Tibet, China 表 2 39份青稞亲本材料的农艺性状
Table 2 Agronomic traits of 39 hulless barley parent materials
编号
code株高/cm
plant height小穗密度/cm−1
spikelet density单株分蘖数
number of tillers per plant单株粒数
grain number per plant千粒质量/g
1000-grain weight1 62.41±0.23 5.82±0.12 6.21±0.12 42.10±0.21 47.20±4.21 2 68.22±5.64 5.63±0.21 6.00±0.22 39.12±1.11 44.61±2.22 3 71.82±6.32 5.84±0.09 5.23±0.23 49.50±0.98 47.52±0.56 4 49.83±1.52 5.00±0.10 8.69±0.74 38.21±3.21 45.33±1.11 5 81.63±4.65 5.83±0.25 6.20±0.34 58.36±2.56 44.00±1.00 6 67.72±2.31 5.85±0.31 6.30±0.44 48.32±5.69 46.96±2.31 7 64.71±5.63 5.20±0.07 6.32±0.89 51.14±0.03 43.30±0.36 8 66.26±2.10 5.40±0.04 6.21±0.06 47.22±4.47 45.45±1.01 9 64.77±3.21 5.00±0.05 6.65±0.07 63.31±6.25 44.32±1.21 10 79.13±4.10 5.41±0.06 7.52±0.09 61.41±4.47 47.11±0.78 11 50.84±5.17 5.41±0.15 7.65±0.25 38.56±6.66 44.76±2.01 12 82.25±6.51 5.24±0.07 7.54±0.23 45.78±0.54 46.84±0.66 13 72.53±2.35 5.43±0.05 7.21±0.23 44.31±1.15 45.25±0.88 14 49.15±1.23 5.00±0.06 11.45±0.56 34.47±0.45 43.81±4.01 15 84.86±1.56 6.00±0.05 7.01±0.14 56.11±0.88 41.00±0.25 16 80.28±2.31 5.62±0.05 7.15±0.10 49.10±2.31 44.94±0.36 17 83.70±3.56 5.29±0.18 14.14±0.25 56.12±1.98 45.00±0.45 18 75.14±0.98 5.87±0.15 8.65±1.02 63.03±0.79 44.32±0.69 19 81.46±0.65 6.28±0.07 9.03±0.56 62.20±1.45 43.91±0.33 20 76.27±1.01 6.00±0.04 6.23±0.45 53.30±0.79 46.75±0.52 21 83.14±1.21 5.00±0.06 8.45±0.56 54.65±1.54 48.32±1.36 22 77.36±2.31 4.46±0.54 9.56±0.56 32.74±4.15 40.34±1.24 23 48.37±3.54 6.25±0.43 15.31±0.23 62.10±4.12 39.52±1.54 24 79.48±3.65 5.36±0.12 6.28±0.25 53.30±0.68 45.11±1.12 25 81.39±1.02 7.00±0.21 6.26±0.65 50.20±1.58 44.00±0.98 26 85.62±2.13 7.21±0.05 9.00±0.15 62.11±0.98 41.51±0.77 27 61.92±0.98 10.00±1.64 9.23±0.45 49.88±3.21 37.92±2.36 28 81.63±2.10 5.20±2.25 7.00±0.77 49.87±3.22 46.22±1.36 29 93.84±1.32 6.00±2.01 7.00±1.02 27.79±1.56 48.74±1.24 30 82.86±0.99 5.84±0.02 12.47±1.63 68.90±1.69 42.63±3.26 31 77.55±1.56 5.25±0.03 7.69±0.56 39.65±1.99 48.51±3.02 32 77.83±1.11 6.00±0.06 8.35±0.99 51.15±2.01 46.55±0.55 33 75.37±1.36 5.44±0.12 8.91±0.74 43.31±2.36 47.42±0.32 34 81.78±0.97 5.00±0.01 9.27±2.10 54.14±1.69 47.00±1.26 35 64.29±0.78 5.40±0.03 9.35±0.11 42.02±1.69 50.11±2.98 36 42.60±1.45 6.00±0.05 10.00±0.36 44.03±1.55 44.55±0.55 37 62.40±4.98 5.00±0.06 9.47±0.05 44.15±1.66 48.13±1.44 38 76.45±3.69 5.25±0.10 17.56±2.13 47.36±2.01 41.61±1.69 39 77.11±4.78 7.00±0.08 16.10±0.99 61.12±2.36 45.80±1.45 最大值 maximum 93.84 10.00 17.56 68.90 50.11 最小值 minimum 42.60 4.46 5.23 27.79 37.92 变异系数 coefficient of variation 0.17 0.16 0.35 0.19 0.06 注:各编号对应的品种见表1;下同。
Note: The corresponding varieties are shown in Tab.1; the same as below.表 3 27对SSR引物在39份青稞材料中的多态性检测
Table 3 Polymorphic detection of 27 SSR primers in 39 hulless barley materials
标记
marker染色体
chromosome距离/cM
distance基因型数量
number of genotype多态性位点数
number of polymorphic
alleles基因多样性
gene diversity多态性信息含量
polymorphism information
contentBmage0872 1H 37.00 4 6 0.6151 0.5395 Bmag345 1H 57.80 3 5 0.7551 0.7104 Bmag382 1H 85.90 8 7 0.7284 0.6862 Scssr08238 1H 141.70 3 6 0.5723 0.4802 Bmag0770 1H 150.80 12 10 0.8435 0.8252 HVGNIRE 2H 12.40 1 2 0.5000 0.3750 GBM1214 2H 33.80 2 3 0.5651 0.4705 Bmag0692 2H 44.90 3 5 0.7541 0.7092 EBmatc0039 2H 92.10 9 8 0.6684 0.6107 Hv49505 3H 36.20 2 3 0.5355 0.4276 Bmag0225 3H 86.80 3 5 0.6801 0.6264 GBM1238 3H 138.00 2 3 0.5651 0.4705 GBM1221 4H 8.40 2 4 0.7485 0.7015 Bmag0808 4H 66.30 3 5 0.7558 0.7125 GBM1220 4H 105.10 3 4 0.6259 0.5574 Bmac0096 5H 54.10 3 4 0.7341 0.6850 Bmag0812 5H 76.40 5 6 0.6318 0.5637 GMS061 5H 124.10 9 7 0.7936 0.7645 Scssr09398 6H 4.60 15 10 0.8718 0.8584 84c21j33 6H 7.16 2 3 0.6233 0.5523 Bmag173 6H 47.80 3 4 0.5815 0.4923 EBmac060 6H 54.60 3 6 0.6538 0.5907 Bmac0047a 6H 62.40 4 5 0.7291 0.6833 GBM1126 7H 6.80 2 4 0.7459 0.6985 GBM5060 7H 31.24 6 7 0.6811 0.6269 Bmag914 7H 55.70 4 5 0.5602 0.4627 Bmag516 7H 85.70 3 5 0.7084 0.6574 合计 total — — — 142 — — 平均 average — — — 5.26 0.6751 0.6125 表 4 关联标记及其对表型变异的解释率
Table 4 Association markers and their interpretation rate to phenotypic variation
性状
trait染色体
chromosomeSSR 表型解释率/%
phenotypic
interpretation rate株高
plant height1H Bmag0770 22.09 4H Bmag0808 10.15 6H 84c21j33 64.79 7H GBM1126 22.13 小穗密度
spikelet density1H Scssr08238 29.39 7H GBM5060 6.26 分蘖数
tiller number1H Bmag0770 22.42 3H Bmag0225 13.70 6H Scssr09398 39.20 单株粒数
grain number per plant1H Bmag382 17.67 5H Bmac0096 16.54 千粒质量
1000-grain weight3H Bmag0225 10.81 3H GBM1238 17.16 6H Scssr09398 42.73 -
[1] 张建华, 肖植文, 杨晓洪, 等. 小杂粮在云南农业产业化中的作用探讨[J]. 云南农业大学学报, 2005, 20(4): 513. DOI: 10.16211/j.issn.1004-390x(n).2005.04.013. [2] 吴舒颖, 高纪儒, 杜艳, 等. 青稞制品加工研究进展[J]. 食品研究与开发, 2021, 42(21): 201. DOI: 10.12161/j.issn.1005-6521.2021.21.030. [3] 苏乐平, 姚晓华, 吴昆仑, 等. 大麦(青稞)籽粒颜色相关研究进展[J]. 江苏农业科学, 2019, 47(18): 70. DOI: 10.15889/j.issn.1002-1302.2019.18.014. [4] CHEN H L, CHEN X, TIAN J, et al. Development of gene based SSR markers in rice bean (Vigna umbellata L.) based on transcriptome data[J]. PLoS One, 2017, 11(3): e0151040. DOI: 10.1371/journal.pone.0151040.
[5] 曾乐, 杨天赐, 姚佳延, 等. 不同大麦品种特异性SSR分子标记的筛选[J]. 麦类作物学报, 2021, 41(1): 20. DOI: 10.7606/j.issn.1009-1041.2021.01.03. [6] MACCAFERRI M, SANGUINETI M C, NOLI E, et al. Population structure and long-range linkage disequilibrium in a durum wheat elite collection[J]. Molecular Breeding, 2005, 15(3): 271. DOI: 10.1007/s11032-004-7012-z.
[7] LIU S B, YANG X P, ZHANG D D, et al. Genome-wide association analysis identified SNPs closely linked to a gene resistant to soil-borne wheat mosaic virus[J]. Theoretical and Applied Genetics, 2014, 127(5): 1039. DOI: 10.1007/s00122-014-2277-z.
[8] KUMAR B, ABDEL-GHANI A H, PACE J, et al. Association analysis of single nucleotide polymorphisms in candidate genes with root traits in maize (Zea mays L.)[J]. Plant Science, 2014, 224: 9. DOI: 10.1016/j.plantsci.2014.03.019.
[9] BOCIANOWSKI J, NOWOSAD K, WRÓBEL B, et al. Identification of associations between SSR markers and quantitative traits of maize (Zea mays L.)[J]. Agronomy, 2021, 11(1): 182. DOI: 10.3390/agronomy11010182.
[10] BRANTESTAM A K, VON BOTHMER R, DAYTEG C, et al. Genetic diversity changes and relationships in spring barley (Hordeum vulgare L.) germplasm of Nordic and Baltic areas as shown by SSR markers[J]. Genetic Resources and Crop Evolution, 2007, 54(4): 749. DOI: 10.1007/s10722-006-9159-4.
[11] 孟亚雄, 张海娟, 马小乐, 等. 89份大麦遗传多样性分析及其网斑病抗性位点相关SSR标记筛选[J]. 农业生物技术学报, 2016, 24(12): 1820. DOI: 10.3969/j.issn.1674-7968.2016.12.003. [12] 张彦军, 苟作旺, 王兴荣, 等. 西北地区和尚头小麦遗传多样性及农艺性状的关联分析[J]. 草业学报, 2019, 28(2): 142. DOI: 10.11686/cyxb2018124. [13] 兰茗清, 刘林, 杨静, 等. 直接、快速地从罹病小麦叶片中提取条锈菌基因组DNA的方法[J]. 云南农业大学学报(自然科学), 2012, 27(6): 798. DOI: 10.3969/j.issn.1004-390X(n).2012.06.005. [14] 赖勇, 孟亚雄, 王晋, 等. 大麦遗传多样性及连锁不平衡分析[J]. 作物学报, 2013, 39(12): 2154. DOI: 10.3724/SP.J.1006.2013.02154. [15] BABU B K, SOOD S, AGRAWAL P K, et al. Molecular and phenotypic characterization of 149 finger millet accessions using microsatellite and agro-morphological markers[J]. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, 2017, 87(4): 1. DOI: 10.1007/s40011-015-0695-6.
[16] LIU X X, WANG L, ZHANG H C, et al. Genetic and fruit trait differences between Chinese elite lines/varieties and American varieties of processing tomato[J]. Scientia Horticulturae, 2017, 224: 251. DOI: 10.1016/j.scienta.2017.06.023.
[17] 张吉顺, 王仁刚, 杨春元, 等. 国内外烤烟品种农艺性状的遗传多样性及与SRAP标记的关联分析[J]. 作物学报, 2012, 38(6): 1029. DOI: 10.3724/SP.J.1006.2012.01029. [18] 杨菁, 迟德钊, 吴昆仑, 等. 青海不同生态区青稞Wx基因遗传多样性研究[J]. 江苏农业科学, 2010(1): 47. DOI: 10.15889/j.issn.1002-1302.2010.01.067. [19] 孟亚雄, 孟祎林, 汪军成, 等. 青稞遗传多样性及其农艺性状与SSR标记的关联分析[J]. 作物学报, 2016, 42(2): 180. DOI: 10.3724/SP.J.1006.2016.00180. [20] 袁金娥. 中国近缘野生大麦和栽培青稞的耐盐性鉴定及其与SSR标记的关联分析[D]. 成都: 四川农业大学, 2012. [21] 王彩洁, 徐冉, 于明飞. 关联分析在植物育种中的应用现状[J]. 山东农业科学, 2012, 44(6): 32. DOI: 10.14083/j.issn.1001-4942.2012.06.009. [22] ALEKSANDROV V, KARTSEVA T, ALQUDAH A M, et al. Genetic diversity, linkage disequilibrium and population structure of bulgarian bread wheat assessed by genome-wide distributed SNP markers: from old germplasm to semi-dwarf cultivars[J]. Plants, 2021, 10(6): 1116. DOI: 10.3390/plants10061116.
[23] 赖勇, 王鹏喜, 范贵强, 等. 大麦SSR标记遗传多样性及其与农艺性状关联分析[J]. 中国农业科学, 2013, 46(2): 233. DOI: 10.3864/j.issn.0578-1752.2013.02.002. [24] WANG H, XU S T, FAN Y M, et al. Beyond pathways: genetic dissection of tocopherol content in maize kernels by combining linkage and association analyses[J]. Plant Biotechnology Journal, 2018, 16(8): 1. DOI: 10.1111/pbi.12889.
[25] 刘筱颖, 李晓华, 郑兴卫, 等. 山西小麦育成品种农艺性状演变趋势及关联分析[J]. 中国农业科技导报, 2020, 22(3): 14. DOI: 10.13304/j.nykjdb.2019.0385. [26] 司二静, 张宇, 汪军成, 等. 大麦农艺性状与SSR标记的关联分析[J]. 作物学报, 2015, 41(7): 1064. DOI: 10.3724/SP.J.1006.2015.01064. [27] HUANG B G, WU W R. Mapping of mutant gene prbs controlling poly-row-and-branched spike in barley (Hordeum vulgare L.)[J]. Agricultural Sciences in China, 2011, 10(10): 1501. DOI: 10.1016/S1671-2927(11)60144-2.
[28] 尚毅, 朱靖环, 华为, 等. 大麦耐迟播高分蘖资源的鉴定与筛选[J]. 麦类作物学报, 2015, 35(8): 1085. DOI: 10.7606/j.issn.1009-1041.2015.08.08. [29] 杨晓梦, 李霞, 普晓英, 等. 大麦重组自交系群体籽粒总花色苷含量和千粒重QTL定位[J]. 作物学报, 2020, 46(1): 52. DOI: 10.3724/SP.J.1006.2020.91024. [30] 张斐斐, 杨雅云, 董超, 等. 关联分析及其在水稻遗传研究中的应用[J]. 云南农业大学学报(自然科学), 2014, 29(5): 752. DOI: 10.3969/j.issn.1004-390X(n).2014.05.022. -
期刊类型引用(3)
1. 李坤,张俊磊,申羽婷,叶树芯,高晴,和劲松. 微酸性电解水和超高压并行联合对三七块茎表面大肠杆菌杀菌效果研究. 食品安全质量检测学报. 2025(01): 223-233 .  百度学术
百度学术
2. 刘野,盛庆林,岳田利,丁亮,肖三雄. 钛基改性DSA电极优化工艺研究与杀菌应用. 农产品加工. 2024(10): 61-65+71 .  百度学术
百度学术
3. 李子怡,侯丽丽,高晴,和劲松. 天麻炖乌鸡的工艺优化及其贮藏品质. 云南农业大学学报(自然科学). 2024(05): 96-105 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: