甘肃省定西市芹菜根腐病发生及病原优势种类分析
Occurrence and Pathogen Dominant Species of Celery Root Rot in Dingxi City, Gansu Province
-
Keywords:
- Fusarium oxysporum /
- Fusarium solani /
- Fusarium acuminatum /
- pathogenicity /
- Dingxi City
-
酿酒酵母(Saccharomyces cererisiae)隶属于子囊菌门(Ascomycota)半子囊菌纲(Hemiascomycetes)酵母目(Saccharomy cetales)酵母科(Saccharomycetaceae) 酵母属[Saccharomyces (E.C.Hansen 1838) Meyen][1]。几千年前人类就已经开始利用酵母,酿酒酵母与人类生产生活息息相关。20世纪中叶以来,酿酒酵母在化工行业和食品生产方面不断得到推广和应用[2],其研究备受关注。大量学者从基因层面研究酿酒酵母,开始利用生物信息学分析法研究酿酒酵母的基因功能。张先昂等[3]采用生物信息学分析方法对贝酵母中ADR1基因进行研究分析,最终发现ADR1基因是贝酵母乙醇代谢过程中与醇脱氢酶相关的正调节基因,同时也是生长过程中必要的调节基因。吴杰新等[4]采用生物信息学分析方法研究了酿酒酵母CAD1基因,结果表明:在重金属镉存在的逆境条件下,CAD1蛋白与SKN7蛋白相互作用,可增强酿酒酵母对镉的抗性。
电子克隆(electronic cloning)又称虚拟克隆(virtual cloning),是以基因数据库为基础,利用表达序列标签(expressed sequence tags,ESTs)和基因组数据库快速克隆已知基因或者找寻新基因的一种克隆方式。1994年,电子克隆方法就被BOGUSKI等用于获取新基因;1996年陈润生等也开始使用电子克隆方法;后续更多学者利用电子克隆的方法搜寻新基因,到现在已经获得了众多功能基因,如与人SR相关的剪切调控蛋白508 (SRp508)基因和TECTB基因等[5]。随着酵母基因组研究的不断完善,电子克隆也被引入到酿酒酵母的基因克隆。
自1980年起,大批学者开始关注PAD1基因,关于微生物体内的PAD1基因已经有所报道。GOODEY等[6]研究发现:啤酒酵母PAD1基因是造成POF+ (POF指引起某些特殊气味的酚类物质)的主要原因;MEADEN等[7]对POF1 (即PAD1)基因进行克隆,并将其转入啤酒酵母中,但转入的PAD1基因沉默;SHINOHARA等[8]对200多种葡萄酒和啤酒酵母进行研究,结果表明:大多数都为POF酵母,并采用Southern Blot方法又一次证明PAD1基因是控制POF+的关键基因。可见,前人研究表明啤酒酵母中PAD1基因可以调节啤酒发酵过程中芳香族化合物的代谢。LARRSSON等[9]在研究木质纤维素水解时发现,当啤酒酵母的PAD1基因过量表达时啤酒中酒精的含量显著增加;STRATFORD等[10]发现有害酵母的PAD1基因可以调控山梨酸脱羧;PLUMRIDGE等[11]发现:黑曲霉中包含的PAD1基因可以调控山梨酸和肉桂酸脱羧。PAD1基因在许多微生物中是芳香族羧酸代谢过程中的重要基因,在现代工业中,芳香族化合物是化工产业的重要原料;在酿造行业,适量芳香族化合物的存在可以极大地提高食品风味。酿酒酵母作为模式生物,其体内也存在PAD1基因,对其功能合理的开发利用可将酿酒酵母引入到芳香族化合物的工业生产和酿造行业,因此,对酿酒酵母中PAD1基因的研究具有重要意义。
本研究通过电子克隆获取酿酒酵母PAD1基因,对PAD1基因所在的染色体进行定位,再通过PAD1基因的碱基序列获得氨基酸序列;借助多种在线分析工具对酿酒酵母PAD1基因编码的蛋白质的理化性质、卷曲螺旋区域、潜在跨膜区、亚细胞定位、二级结构以及三级结构进行分析预测[3,12],进而为研究酿酒酵母中PAD1基因在芳香族化合物代谢过程中的作用和途径奠定基础。
1. 材料与方法
1.1 酿酒酵母PAD1基因序列的电子克隆
1.1.1 电子克隆探针的选取
对NCBI数据库(https://www.ncbi.nlm.nih.gov)中已知的PAD1基因进行搜索,选取并下载1条与酿酒酵母亲缘关系较近的物种PAD1基因cDNA序列[13],然后利用NCBI数据库的BLAST工具进行检索,从检索结果中选取多条同源性高(大于50%)的基因序列;利用同源性比对软件MEGA-Ⅹ进行DNA同源性比对,再从比对结果中选择高度保守的核苷酸序列片段(同源性为100%且连续碱基数大于18的核苷酸序列片段)作为探针。
1.1.2 酿酒酵母基因组获取
从酵母基因组数据库(saccharomyces genome database,SGD)中下载酿酒酵母菌株X2180-1A(S. cerevisiae X2180-1A)的全基因组序列[14],并将其格式转换为文档格式保存。
1.1.3 目的基因在基因组中的定位
利用Word的查找工具查找探针核苷酸序列在酵母基因组序列中的对应位置并进行标记。
1.1.4 目的基因序列的获取
PAD1基因长度一般小于1 000 bp,因此以探针标记的位置为中心,上、下游分别延伸1 000 bp,获得1个长度约为2 000 bp的核苷酸序列,即为探针延伸序列;将该序列提交至NCBI提供的开放阅读框(open reading frame,ORF)查找工具中查找ORF,查找结果中最长且最完整的ORF所对应的核苷酸序列即为电子克隆的目的基因序列。
1.2 酿酒酵母PAD1基因的生物信息学分析
1.2.1 染色体定位
将电子克隆获得的核苷酸序列提交到NCBI数据库(https://www.ncbi.nlm.nih.gov/gene/852150)中查询即可获得酿酒酵母PAD1基因的序列长度、基因编号、基因结构以及所在染色体的定位等基本信息[3]。
1.2.2 编码蛋白质的进化树分析
将PAD1基因的碱基序列导入到NCBI数据库,利用NCBI数据库提供的在线分析工具BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)对酿酒酵母PAD1核苷酸序列进行翻译,获得对应编码的氨基酸序列;对该氨基酸序列进行比对,从比对结果中选择并下载多条与该氨基酸序列具有较高同源性的氨基酸序列,构建PAD1基因的系统发生树,分析PAD1基因编码蛋白质与所选取的多条氨基酸序列之间的亲缘关系。建立系统进化树过程中,将参与建树的全部氨基酸序列导入分子进化遗传分析软件Mega-Ⅹ进行多序列比对,采用邻接法(neighbour-joining) (执行参数:Bootstrap method 1 000;Poisson model;Pairwise deletion)进行系统进化树构建[15-17]。
1.2.3 编码蛋白质的基本性质分析
蛋白质序列的基本性质分析通常包括其理化性质、亲/疏水性、信号肽和亚细胞定位等4个方面[18]。使用在线分析工具ProtParam (https://web.expasy.org/protparam/)分析PAD1基因编码蛋白质的理化性质;使用在线分析软件ProtScale (https://web.expasy.org/protscale/)分析预测PAD1基因编码蛋白质的亲/疏水性;使用信号肽在线预测软件SignalP 3.0 (http://www.cbs.dtu.dk/services/SignalP-3.0/)对PAD1基因编码蛋白质进行预测;使用在线分析工具TargetP 1.1 (http://www.cbs.dtu.dk/services/TargetP-1.1/index.ph)和PSORT Ⅱ(https://psort.hgc.jp/form2.html)预测PAD1基因编码蛋白质的亚细胞定位。
1.2.4 编码蛋白质的二级结构预测
使用在线分析工具TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)预测PAD1基因编码蛋白质的跨膜区域;使用在线分析工具COILS Server (https://embnet.vital-it.ch/software/COILS_form.html)预测PAD1基因编码蛋白质的Coil区;使用在线分析工具SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测PAD1基因编码蛋白质的二级结构。
1.2.5 编码蛋白质的三级结构预测
使用基于同源建模的在线三维空间结构分析工具Swiss-Model (https://swissmodel.expasy.org/)对酿酒酵母PAD1基因所编码蛋白质的三级结构进行预测[3-4,19-20]。
2. 结果与分析
2.1 获取的酿酒酵母PAD1序列
2.1.1 选取的电子克隆探针
通过NCBI进行BLAST,从结果中选取S. cerevisiae strain Y169 chromosome Ⅳ (ID:CP033473.1)、S. cerevisiae strain SY14 chromosome I, complete sequence (ID:CP029160.1)、S. cerevisiae strain BY4742 chromosome Ⅳ, complete sequence (ID:CP026298.1)、S. cerevisiae strain S288c chromosome Ⅳ, complete sequence (ID:CP020126.1)和S. cerevisiae YJM555 chromosome Ⅳ sequence (ID:CP004677.2)共5条同源性较高的核苷酸序列,经MEGA-X同源性比对后选取探针序列为:AGGATTTAATTACAAGAGCTGCCGATGTTTCGATTAAAGAGAATCGTAAGTTACTACTGGTTACTCGGGAAACCCCTTTATCTTCCATCCATCTTGAAAACATGTTGTCT。
2.1.2 获取的目的基因序列
将包含目的基因的探针延伸序列提交到NCBI数据库提供的开放阅读框查找工具,共获得19个ORF,其中最长且最完整的1条为ORF8。该核苷酸序列经BLAST后,结果 (图1) 显示:该基因编码的蛋白质与酿酒酵母S288C菌株PAD1基因编码的蛋白质序列同源性高达100%,即认为该核苷酸序列是所要获取的目的基因序列。
2.2 酿酒酵母PAD1基因染色体定位
酿酒酵母PAD1基因导入到NCBI基因数据库查询,结果表明:酿酒酵母PAD1又称POF1,RNA名称phenylacrylic acid decarboxylase PAD1,外显子数为1,全长729 bp,基因组序列:NC_001136.10,基因编号851730,染色体定位于Ⅳ染色体1 510 902~1 511 630。
2.3 PAD1基因的系谱发生分析
酿酒酵母PAD1基因的碱基序列全长为729 bp,其编码的蛋白质由242个氨基酸连接构成。核苷酸序列与氨基酸序列对应如图2所示。
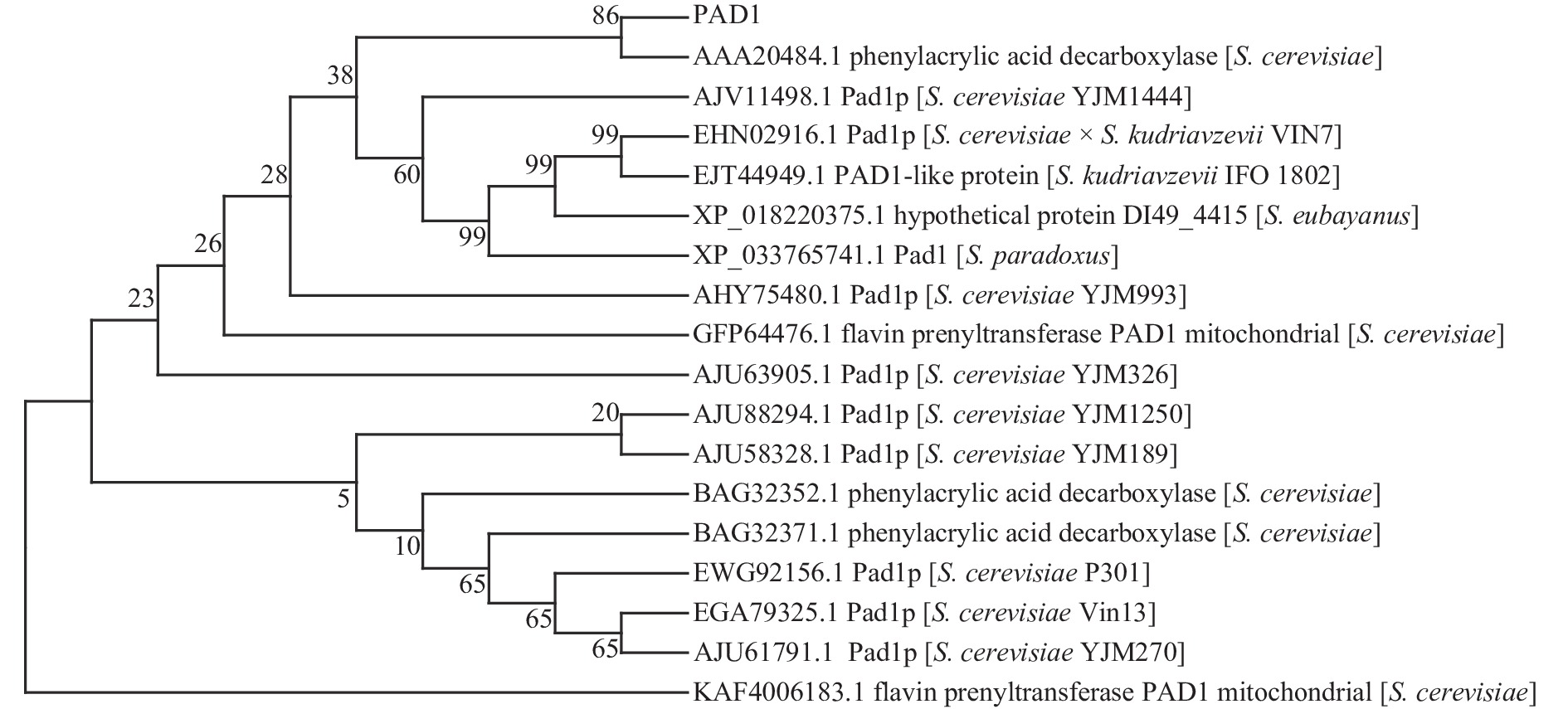
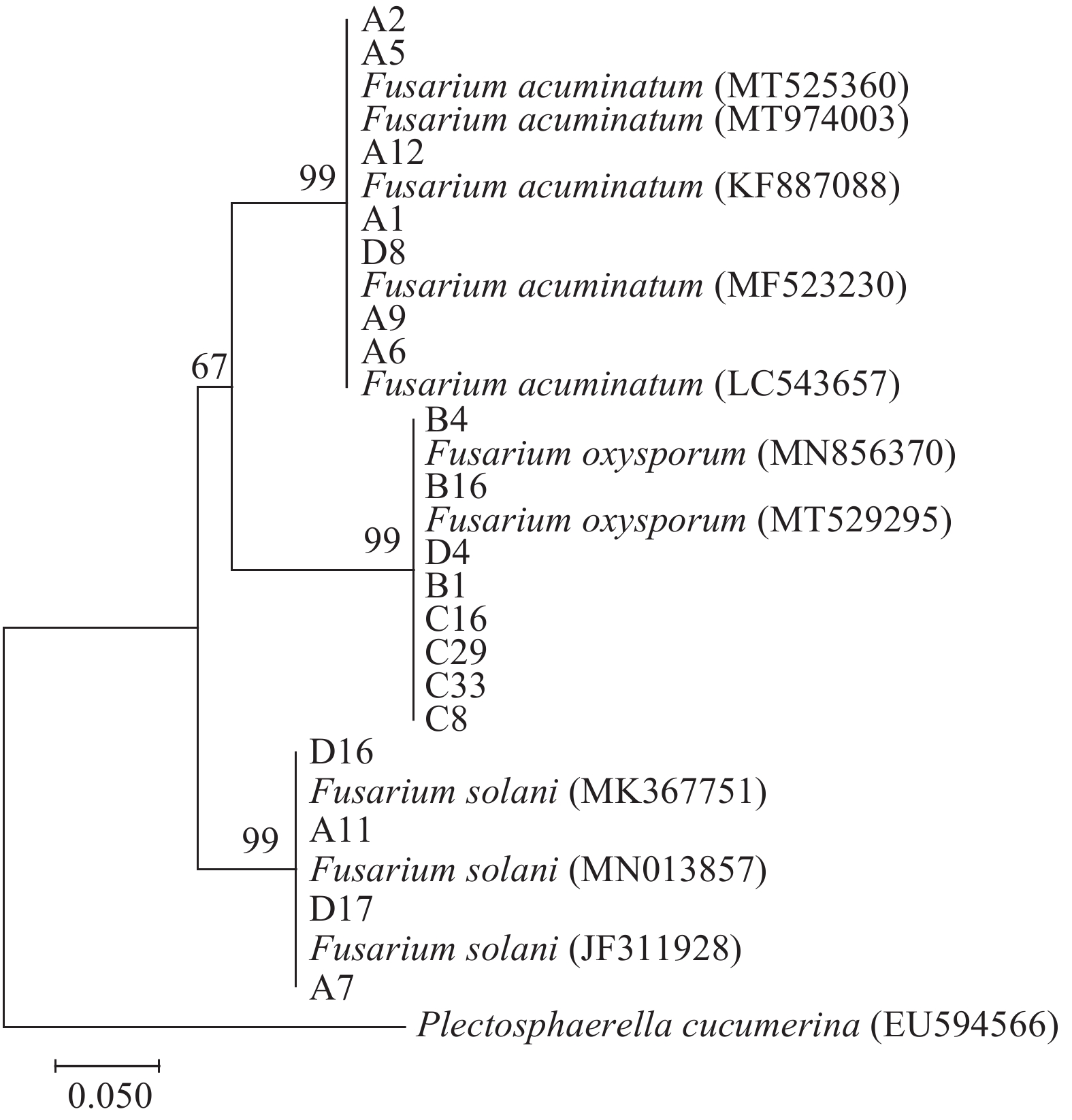
将由酿酒酵母PAD1基因翻译获得氨基酸序列导入到NCBI在线分析工具中进行蛋白质的BLASTP,从结果中选取同源性较高的17条蛋白质序列(表1)构建系统进化树(图3),结果显示:克隆得到的酿酒酵母PAD1基因所编码的蛋白质和6种酿酒酵母聚为一类,且与肉桂酸脱羧酶(AAA20484.1)最为接近,二者同源性高达99.59%,说明本研究克隆的PAD1基因序列正确无误。
表 1 同源性较高的17条蛋白质序列Table 1. 17 protein sequences with high homology序列名称
sequences name物种
species同源性/%
homology序列ID
sequence IDphenylacrylic acid decarboxylase S. cerevisiae 99.59 AAA20484.1 phenylacrylic acid decarboxylase S. cerevisiae 98.76 BAG32352.1 flavin prenyltransferase PAD1, mitochondrial S. cerevisiae 98.76 GFP64476.1 flavin prenyltransferase PAD1, mitochondrial S. cerevisiae 98.76 KAF4006183.1 phenylacrylic acid decarboxylase S. cerevisiae 98.35 BAG32371.1 Pad1p S. cerevisiae P301 98.35 EWG92156.1 Pad1p S. cerevisiae Vin13 98.53 EGA79325.1 Pad1p S. cerevisiae × S. kudriavzevii VIN7 80.99 EHN02916.1 Pad1p S. cerevisiae YJM1250 98.35 AJU88294.1 Pad1p S. cerevisiae YJM1444 98.76 AJV11498.1 Pad1p S. cerevisiae YJM189 99.17 AJU58328.1 Pad1p S. cerevisiae YJM270 98.76 AJU61791.1 Pad1p S. cerevisiae YJM326 98.76 AJU63905.1 Pad1p S. cerevisiae YJM993 98.76 AHY75480.1 hypothetical protein DI49_4415 S. eubayanus 83.06 XP_018220375.1 PAD1-like protein S. kudriavzevii IFO 1802 81.82 EJT44949.1 Pad1 S. paradoxus 91.32 XP_033765741.1 2.4 酿酒酵母PAD1基因编码的蛋白质基本性质分析
2.4.1 理化性质分析
酿酒酵母PAD1基因编码的蛋白质包含242个氨基酸,该蛋白质由C、H、N、O和S等5种元素共同构成,每个蛋白质分子包含3 831个原子,蛋白质分子式为C1208H1950N328O336S9,相对分子质量约为26 733.31 ku;该蛋白在pH为9.69的溶液中呈电中性,即该蛋白质理论等电点为9.69;在构成PAD1基因编码蛋白的所有氨基酸中,含量最高的是亮氨酸(10.7%),含量最低的是色氨酸(1.2%);吡咯赖氨酸和硒半胱氨酸在该蛋白中都不存在;不稳定指数为33.74,表明该蛋白是一个稳定的蛋白质;脂肪指数为100.74,平均亲水系数为0.137。
2.4.2 亲/疏水性分析
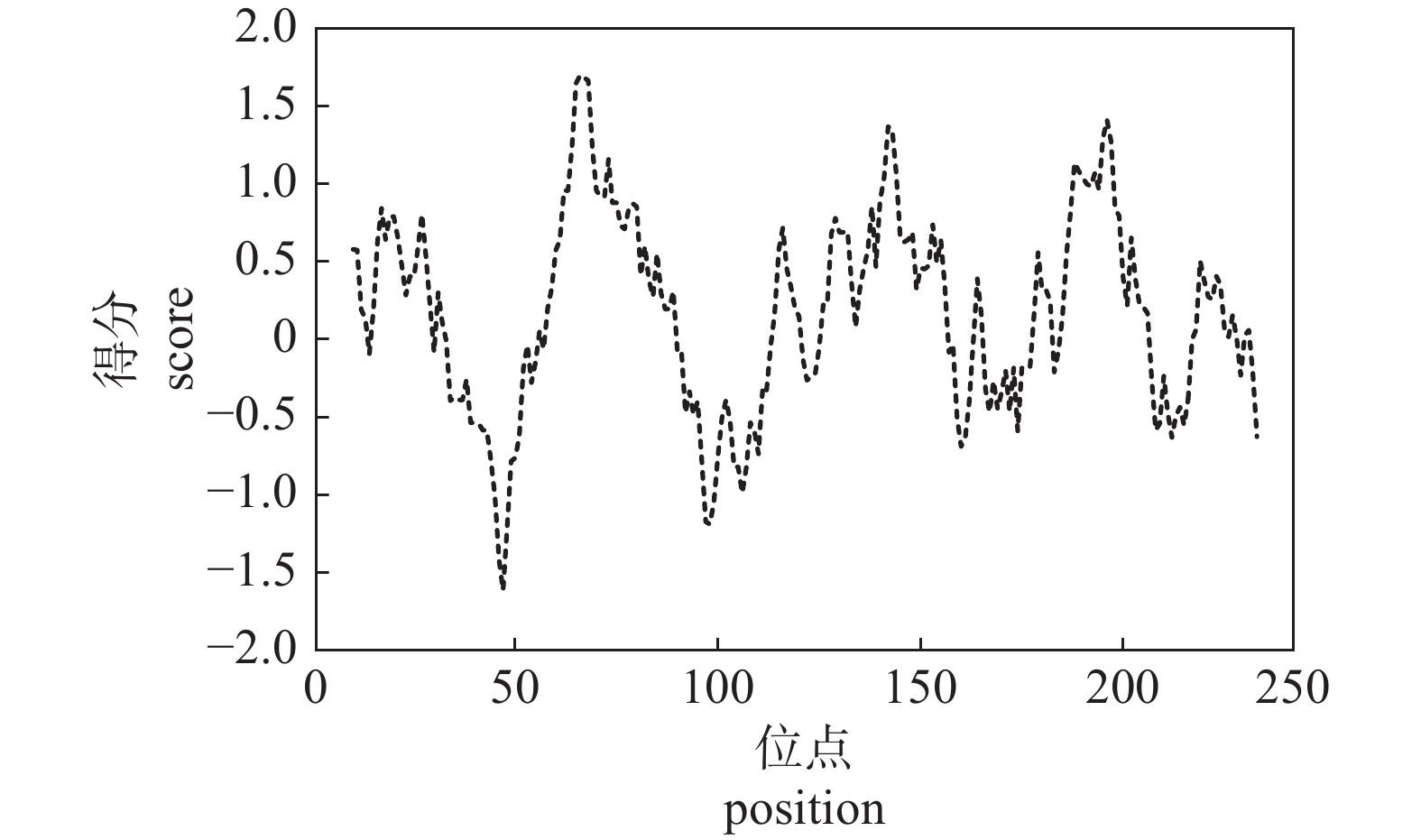
由图4可知:高分值峰(score>1.5)存在,故推断该蛋白可能存在潜在的跨膜区;4个高分值峰分别位于66、142、188和196氨基酸位点附近,在66位点出现最高峰,峰值为1.700;于47和97氨基酸位点附近分别出现2个低分值峰位,分值分别为−1.616和−1.174;从整体图像来看,正值的占比大于负值的占比。根据氨基酸疏水特性参数规律来看,氨基酸疏水性越强则疏水特性参数通常为越高的正值,而氨基酸的亲水性强时则疏水特性参数通常为越低的负值[21],故推断PAD1基因所编码的蛋白为疏水性蛋白,该推断与理化性质分析结果相符。
2.4.3 信号肽预测
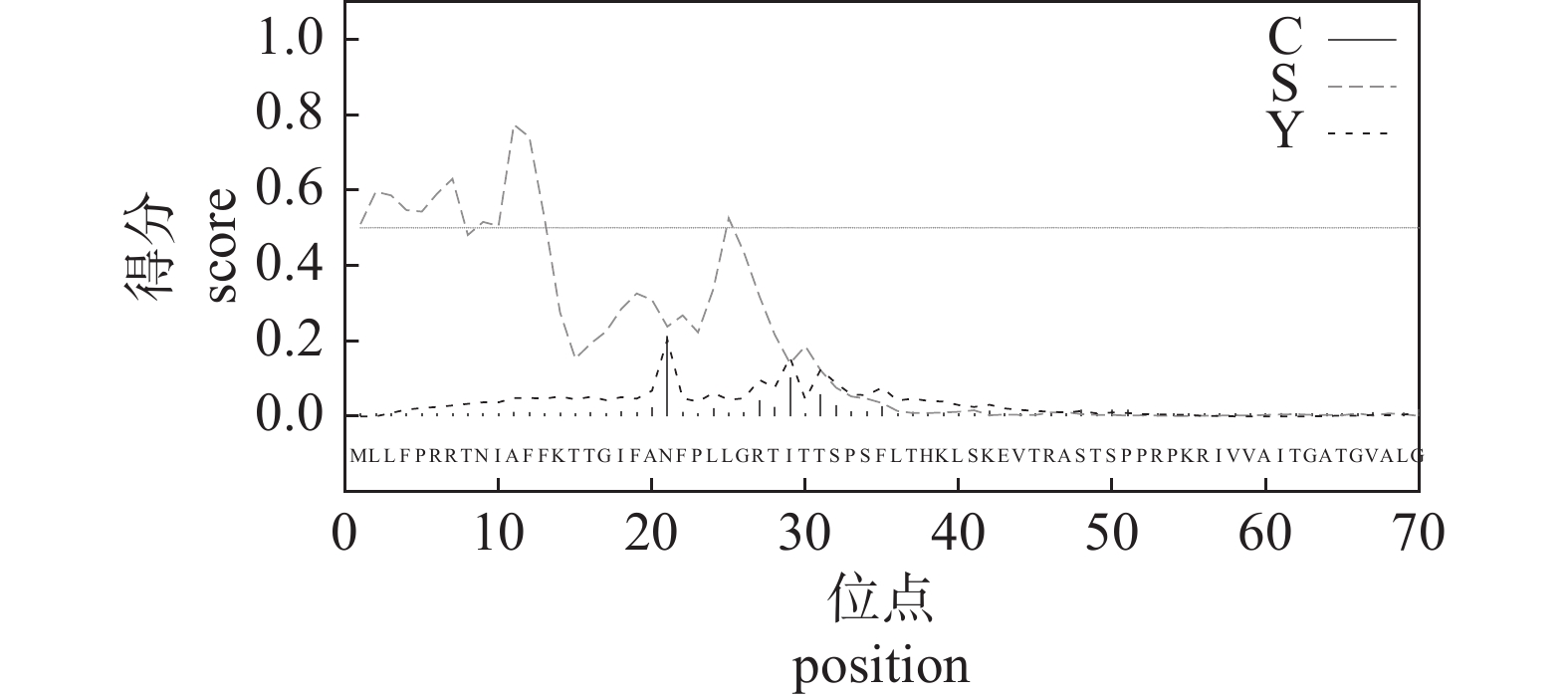
由图5可知:酿酒酵母PAD1基因编码的蛋白属于非分泌蛋白,信号肽存在的概率为0.070,锚定蛋白存在的概率为0.372,在30和31氨基酸位点之间存在最大切割位点的概率为0.035。
![]() 图 5 PAD1基因编码蛋白质的信号肽预测注: C表示存在剪切位点的得分;S表示存在信号肽的得分;Y表示存在综合剪切位点的得分。Figure 5. Signal peptide prediction of protein encoded by the PAD1 geneNote: C indicates the score for the presence of a shear site; S indicates the score for the presence of a signal peptide; Y indicates the score for the presence of a combined shear site.
图 5 PAD1基因编码蛋白质的信号肽预测注: C表示存在剪切位点的得分;S表示存在信号肽的得分;Y表示存在综合剪切位点的得分。Figure 5. Signal peptide prediction of protein encoded by the PAD1 geneNote: C indicates the score for the presence of a shear site; S indicates the score for the presence of a signal peptide; Y indicates the score for the presence of a combined shear site.2.4.4 亚细胞定位预测
TargetP预测结果表明:该蛋白定位于线粒体的可能性最大(概率为0.795),位于分泌通路的概率为0.066,位于其他位置的可能性最小(概率为0.104),由PAD1基因所编码蛋白的分泌途径为“M”型,且可靠等级为2,即定位到线粒体。PSORT Ⅱ预测结果显示:该蛋白亚细胞定位的可能性从大到小依次是线粒体、内质网、高尔基体、细胞质和细胞核,概率依次为47.8%、26.1%、13.0%、8.7%和4.3%。
2.5 酿酒酵母PAD1基因编码的蛋白质二级结构预测
2.5.1 蛋白质的跨膜区域分析
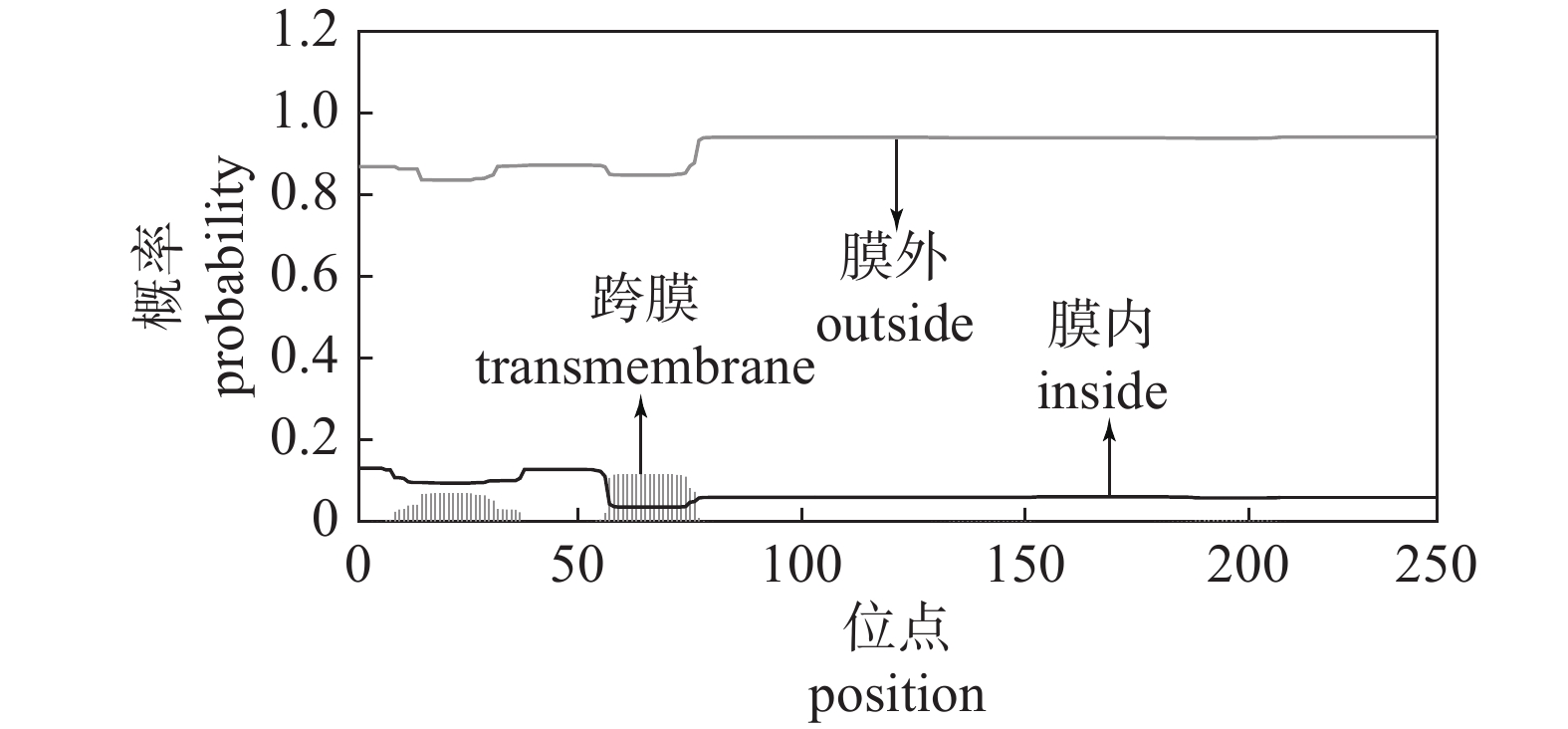
由图6可知:该蛋白有部分跨膜区域存在。蛋白质含有跨膜区,表示它可能作为膜受体起作用,也可能是在膜上的锚定蛋白或离子通道蛋白[22-23],这些蛋白均不溶于水,故推断该PAD1基因编码的蛋白质为脂溶性蛋白。这些结果均与蛋白亲/疏水性分析的推测结果相符。
2.5.2 蛋白质的Coil区分析
由图7可知:在Window14、28和21窗口中酿酒酵母PAD1基因编码的蛋白质残基都不存在卷曲螺旋区域,故推断酿酒酵母PAD1基因编码的蛋白无卷曲螺旋区域存在。
2.5.3 蛋白质的二级结构预测
预测酿酒酵母PAD1基因编码的蛋白质二级结构如图8所示。二级结构的组件含量自少至多依次为β-转角、延伸链、α-螺旋、随机卷曲,其数量分别为20、34、84和104,其含量占比分别为8.26%、14.05%、34.71%、42.98%。可见,在PAD1基因所编码的蛋白质二级结构中,α-螺旋和随机卷曲是主要组件,β-转角与延伸链在蛋白中分散存在。
2.6 酿酒酵母PAD1基因编码蛋白质三级空间结构预测
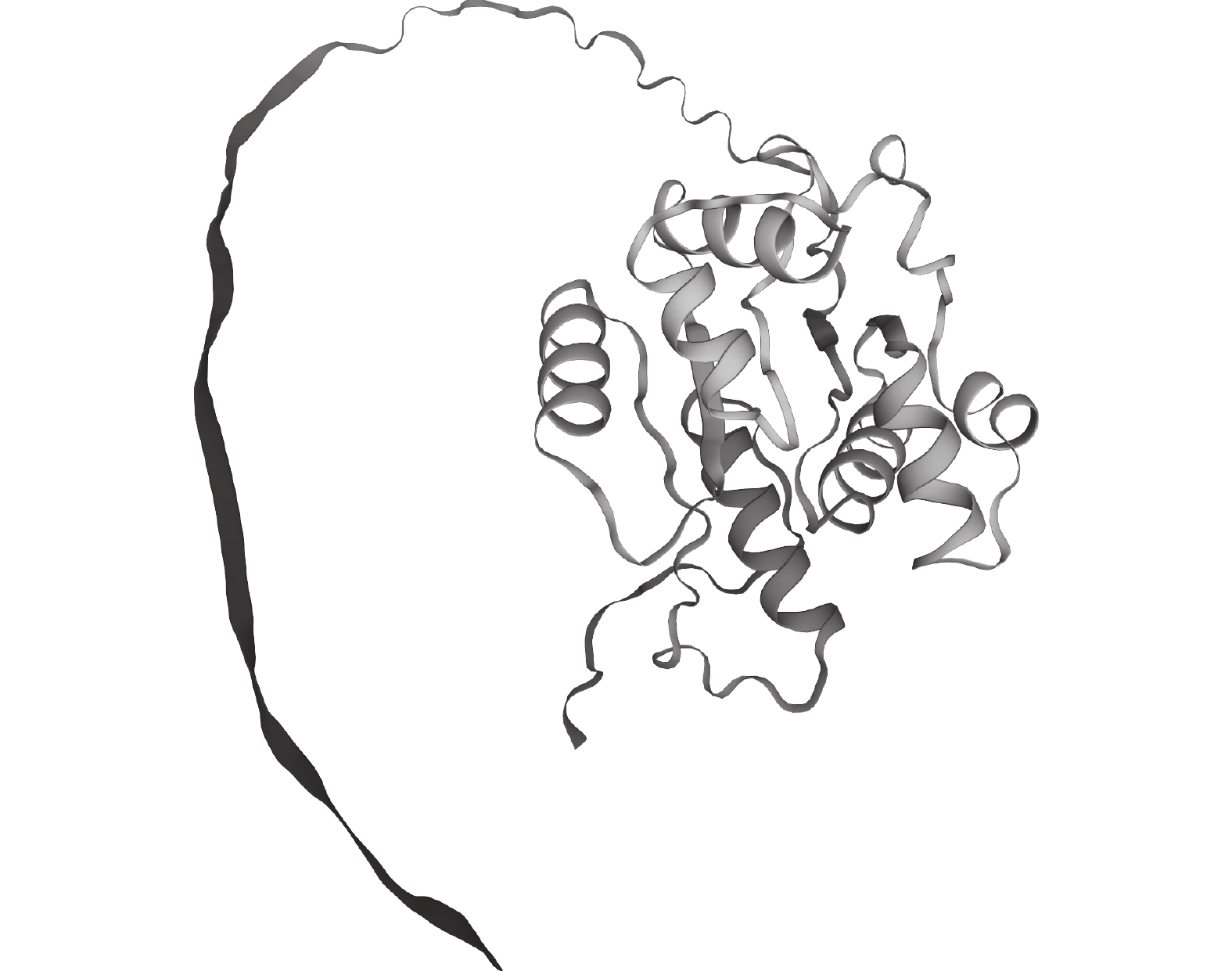
酿酒酵母PAD1基因所编码蛋白质的三级如图9所示。
3. 讨论
自20世纪80年代以来,有学者就微生物体内的PAD1基因展开了较全面地研究。PLUMRIDGE等[11]发现黑曲霉中含有PAD1基因,并证明了黑曲霉的 PAD1基因是苯基丙烯酸脱羧相关的、芳香族羧酸脱羧重要的调控基因,可以调控山梨酸和肉桂酸的脱羧。RICHARD等[24]在研究酿酒酵母中FDC1基因和PAD1基因的表达时发现:PAD1基因可编码1种肉桂酸脱羧酶,可将反式肉桂酸转化为苯乙烯;当只有PAD1基因表达时,酿酒酵母对肉桂酸的耐受性与PAD1蛋白含量成正比,最高可耐受0.6 mmol/L肉桂酸;当PAD1基因和FDC1基因都同时表达时,PAD1蛋白和FDC1蛋白出现了明显的相互作用,使酿酒酵母对肉桂酸的耐受性最高可达到10 mmol/L。本研究发现:PAD1基因编码的蛋白质与编码肉桂酸脱羧酶的酿酒酵母 (Saccharomyces cerevisiae, AAA20484.1)同源性高达99.59%,即PAD1基因编码的蛋白质极大可能是芳香族羧酸脱羧酶,参与微生物体内芳香族羧酸的代谢,能够赋予酿酒酵母对肉桂酸的抗性,这与PLUMRIDGE等[11]和RICHARD等[24]的研究结果一致。
肉桂酸经脱羧酶可转化成苯乙烯。苯乙烯是现代工业中的关键单体,可用于生产丁苯橡胶、离子交换树脂、苯乙烯系列树脂和医药品原料,在染料、农药制药、石油和选矿等行业也被广泛应用[25]。MCKENNA等[26]曾将大肠杆菌用于苯乙烯的生产;随着基因工程技术的发展,采用合适技术充分利用酿酒酵母PAD1基因的功能特性选育能使肉桂酸快速脱羧的酿酒酵母菌株,再将该菌株用于生产苯乙烯,可为低成本的苯乙烯及其副产品商业生产提供新途径。此外,果酒受到越来越多人的关注和喜爱,其独特的口感将成为最大的卖点。研究表明:乙烯基愈创木酚、4-乙基愈创木酚、苯乙醇和乙酸-2-苯乙酯等一系列的芳香族化合物、脂类、有机酸以及硫化物等是使果酒具有特殊香味的重要原因[27-31]。随着分子生物技术的不断发展,合理利用PAD1基因调控酿酒酵母中芳香族化合物的代谢,将有可能极大地提高酒的品质。
4. 结论
酿酒酵母PAD1基因是编码芳香族羧酸脱羧酶的基因,编码的蛋白质结构稳定,可能在线粒体中参与代谢,与酿酒酵母芳香族羧酸的代谢和其对芳香族羧酸的耐受性存在直接联系。本研究为后期该基因应用于芳香族化合物的生产奠定了基础。
-
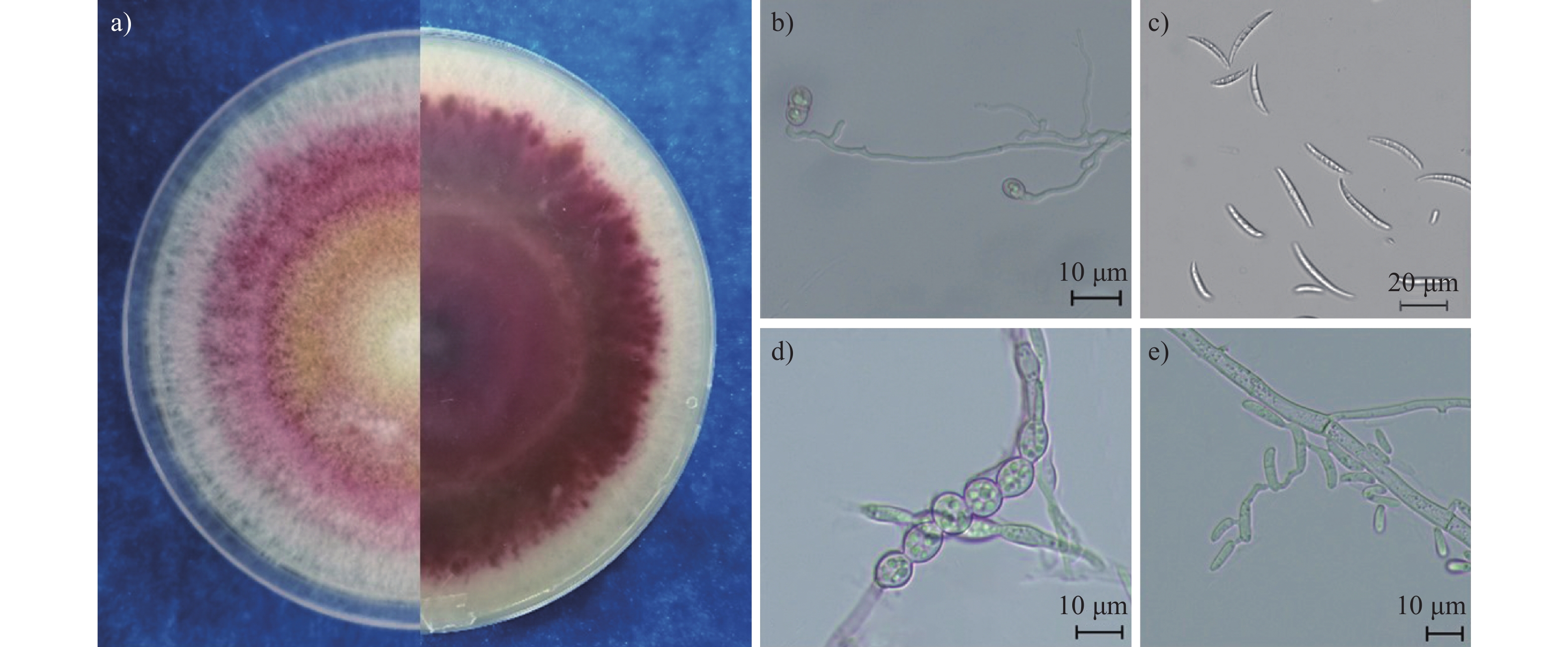
图 1 定西市芹菜根腐病田间症状
注:a) 发病芹菜 (1、2、3) 与健康 (4) 芹菜;b) 田间症状;c) 茎基部缢缩腐烂;d) 下部主根腐烂;e)和f) 茎基部维管束变色。
Figure 1. Field symptoms of celery root rot in Dingxi City
Note: a) diseased (1, 2, 3) and healthy (4) celery; b) field symptoms; c) stem base rot with constriction; d) lower taproot rot; e) and f) vascular bundle of stem discolor.
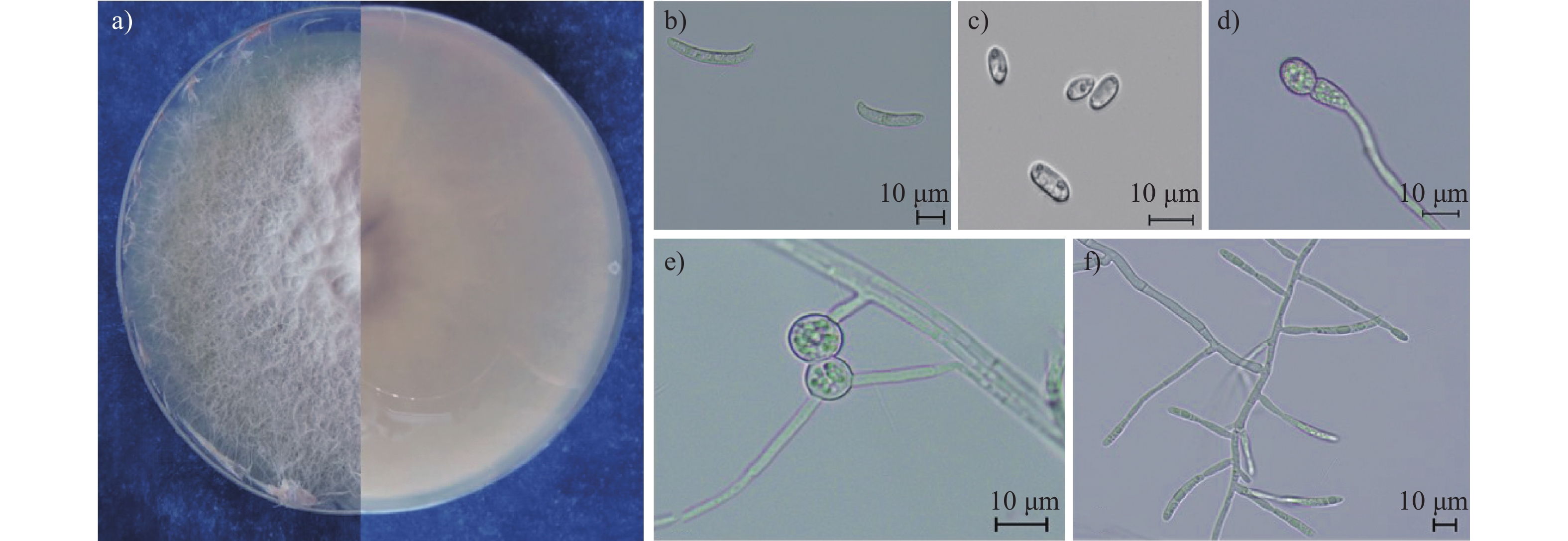
图 2 尖孢镰孢菌培养性状与形态特征
注:a) 培养菌株正面 (左) 和背面 (右)的形态,下同;b) 大分生孢子;c) 小分生孢子;d)和e) 厚垣孢子;f) 大分生孢子产孢结构。
Figure 2. Culture and morphological characteristics of Fusarium oxysporum
Note: a) frontage (left) and backside (right) morphology of cultured strain, the same as below; b) macroconidium; c) microconidium; d) and e) chlamydospores; f) conidiogenous cell of macroconidium.
表 1 芹菜根腐病鉴定所用引物序列
Table 1 Primer sequence for identification of celery root rot
基因
gene引物
primer序列 (5′→3′)
sequence目的片段长度/bp
target fragment lengthrDNA-ITS ITS1 TCCGTAGGTGAACCTGCGG 750 ITS4 TCCTCCGCTTATTGATATGC TEF-1α EF-1H ATGGGTAAGGAGGACAAGAC 700 EF-2T GGAAGTACCAGTGATCATGTT 表 2 定西市芹菜产区根腐病发生情况调查
Table 2 Investigation of root rot disease in celery of Dingxi City
% 采样地
sampling site病田率
diseased field rate病株率
diseased plant rate团结镇
Tuanjie Town马家寺村 Majiasi Village 25.00±25.00 bc 8.25±8.25 bc 唐家堡 Tangjiabu 45.83±20.84 bc 23.45±8.84 bc 东坡村 Dongpo Village 25.00±25.00 bc 17.50±17.50 bc 马河镇
Mahe Town陇海线 Longhaixian 0.00±0.00 c 0.00±0.00 c 化家川 Huajiachuan 100.00±0.00 a 67.50±11.09 a 巉口镇
Chankou Town东川村 Dongchuan Village 100.00±0.00 a 27.29±4.69 abc 赵家卜村 Zhaojiabo Village 100.00±0.00 a 35.00±8.66 abc 西巩驿镇
Xigongyi Town营房村 Yingfang Village 100.00±0.00 a 21.25±9.66 bc 南河 Nanhe 100.00±0.00 a 48.75±21.83 ab 鲁家沟镇
Lujiagou Town小岔口村 Xiaochakou Village 100.00±0.00 a 30.00±15.68 abc 凤翔镇
Fengxiang Town红土坡 Hongtupo 75.00±25.00 ab 22.5±10.30 bc 苏家湾村 Sujiawan Village 53.80±15.11 ab 12.00±3.67 bc 内官镇
Neiguan Town万崖村 Wanya Village 25.00±25.00 bc 8.33±8.33 bc 符川镇
Fuchuan Town高阳村 Gaoyang Village 39.98±20.19 bc 34.50±22.59 abc 注:表中数据为“平均值±标准误”;不同小写字母表示在0.05水平差异显著。
Note: Data used by mean±SE; different lowercase letters indicate significant difference at 0.05 level. -
[1] 刘雄, 马腾, 高建德, 等. 芹菜药用价值研究进展[J]. 甘肃中医学院学报, 2015, 32(2): 74. [2] CHEEPTHAM N, TOWERS G H N. Light-mediated activities of some Thai medicinal plant teas[J]. Fitoterapia, 2002, 73(7/8): 651. DOI: 10.1016/S0367-326X(02)00224-1.
[3] 杨海兴, 张晶, 李强, 等. 兰州高原夏菜芹菜标准化栽培技术[J]. 中国蔬菜, 2019(1): 92. [4] 扈顺, 高婧, 王勇, 等. 西芹根腐病病原菌的分离与鉴定[J]. 北方农业学报, 2019, 47(5): 65. DOI: 10.3969/j.issn.2096-1197.2019.05.12. [5] 张悦丽, 张博, 马立国, 等. 芹菜根茎腐病病原鉴定[J]. 植物保护学报, 2017, 44(2): 347. DOI: 10.13802/j.cnki.zwbhxb.2017.2016144. [6] 耿丽华, 宫国义, 宋顺华, 等. 西瓜种传枯萎病病原菌鉴定及其防控方法[J]. 植物保护学报, 2019, 46(2): 330. DOI: 10.13802/j.cnki.zwbhxb.2019.2017215. [7] 曹雪梅, 李生兵, 张惠玲, 等. 甘草根腐病病原菌鉴定[J]. 植物病理学报, 2014, 44(2): 213. DOI: 10.3969/j.issn.1672-6820.2017.02.002. [8] BIENAPFL J C, MALVICK D K, PERCICH J A J P D. First report of Fusarium redolens causing root rot of soybean in Minnesota[J]. Plant Disease, 2010, 94(8): 1069. DOI: 10.1094/PDIS-94-8-1069B.
[9] 李敏权, 柴兆祥, 李金花, 等. 定西地区苜蓿根和根颈腐烂病病原研究[J]. 草地学报, 2003, 11(1): 83. DOI: 10.3969/j.issn.1007-0435.2003.01.017. [10] 李雪萍, 许世洋, 汪学苗, 等. 青海省青稞根腐病调查及病原菌鉴定[J]. 植物保护学报, 2021, 48(4): 757. DOI: 10.13802/j.cnki.zwbhxb.2021.2020135. [11] 石娟娟, 禄冈强, 陈爱昌, 等. 不同处理时长对棉隆土壤处理防治芹菜根腐病防治效果的研究[J]. 现代农业研究, 2020, 26(7): 48. DOI: 10.19704/j.cnki.xdnyyj.2020.07.022. [12] 丛丽丽, 康俊梅, 张铁军, 等. 苜蓿镰刀菌根腐病病原菌的分离鉴定与致病性分析[J]. 草地学报, 2017, 25(4): 857. DOI: 10.11733/j.issn.1007-0435.2017.04.025. [13] 邱小燕, 汤智鹏, 张敏, 等. 一种适用于多数植物病原真菌的单孢分离方法[J]. 安徽农业科学, 2011, 39(9): 5263. DOI: 10.3969/j.issn.0517-6611.2011.09.086. [14] LESLIE J F, SUMMERELL B A. The Fusarium laboratory manual[M]. Oxford: Blackwell Publishing, 2006.
[15] 王拱辰, 郑重, 叶琪明, 等. 常见镰刀菌鉴定指南[M]. 北京: 中国农业科技出版社, 1996. [16] 曹瑱艳, 杨怡华, 申屠旭萍, 等. 浙江省铁皮石斛根腐病病原真菌的鉴定[J]. 植物保护学报, 2020, 47(1): 178. DOI: 10.13802/j.cnki.zwbhxb.2020.2019040. [17] 杨波, 王喜刚, 郭成瑾, 等. 引起青海省马铃薯根腐类病害的镰刀菌种类鉴定[J]. 植物病理学报, 2019, 49(3): 420. DOI: 10.13926/j.cnki.apps.000382. [18] 李雪萍, 李建宏, 漆永红, 等. 青稞根腐病对根际土壤微生物及酶活性的影响[J]. 生态学报, 2017, 37(17): 5640. DOI: 10.5846/stxb201605311049. [19] 闫文雪, 石延霞, 柴阿丽, 等. 豇豆根腐病病原菌鉴定[J]. 植物保护学报, 2019, 46(3): 717. DOI: 10.13802/j.cnki.zwbhxb.2019.2018069. [20] 孙璘, 海艳, 唐晓雪, 等. 新疆棉花茎腐病的病原鉴定及其生物学特性研究[J]. 棉花学报, 2021, 33(3): 235. DOI: 10.11963/1002-7807.sllgy.20210423. [21] 王玲娜. 内蒙芹菜连做障碍微生物修复研究[D]. 杨凌: 西北农林科技大学, 2010. [22] 郝永娟, 高苇, 刘春艳, 等. 芹菜死苗的原因与防治[J]. 北方园艺, 2013(16): 63. [23] 石延霞, 孟姗姗, 陈璐, 等. 李宝聚博士诊病手记(七十一): 芹菜根腐类病害的病原菌鉴定及新型防治技术[J]. 中国蔬菜, 2014(6): 71. DOI: 10.3969/j.issn.1000-6346.2014.06.017. [24] 晋知文. 芹菜根腐病原菌鉴定、检测与防治技术研究[D]. 北京: 中国农业科学院, 2016. [25] 王国荣, 冯晓晓, 吴慧明, 等. 芹菜茎基腐病病原菌鉴定、消长动态调查与防治药剂筛选[J]. 浙江农业学报, 2021, 33(4): 661. DOI: 10.3969/j.issn.1004-1524.2021.03.11. [26] 王喜刚, 杨波, 郭成瑾, 等. 宁夏回族自治区马铃薯镰刀菌根腐病病原菌的分离鉴定与致病性测定[J]. 植物保护学报, 2020, 47(3): 609. DOI: 10.13802/j.cnki.zwbhxb.2020.2019073. [27] 胡兰, 姜钰, 徐秀德. 基于形态学和EF-1α序列特征的我国高粱子粒寄藏镰孢菌种群鉴定[J]. 作物杂志, 2013(4): 129. DOI: 10.16035/j.issn.1001.2013.04.009. [28] 张祥丽, 曹瑱艳, 杨怡华, 等. 铁皮石斛镰刀菌根腐病病原菌的鉴定及其对链霉菌发酵液的敏感性分析[J]. 中国生物防治学报, 2022, 38(1): 258. DOI: 10.16409/j.cnki.2095-039x.2022.02.004. [29] 赵丽英, 邓西平, 山仑. 水分亏缺下作物补偿效应类型及机制研究概述[J]. 应用生态学报, 2004, 15(3): 523. DOI: 10.3321/j.issn:1001-9332.2004.03.033. [30] 王家和, 王崇德. 云南省蚕豆枯萎病发生特点及复合侵染研究[J]. 云南农业大学学报, 2002, 17(4): 449. DOI: 10.3969/j.issn.1004-390X.2002.04.062. [31] 姚天明, 伏建增, 南建军, 等. 尖孢镰刀菌及欧文氏杆菌复合侵染引起的半夏腐烂病研究[J]. 甘肃农业科技, 2020(7): 54. [32] 张德珍, 李鹏昌, 陈晓霞, 等. 山东省小麦根腐病病原菌的分离鉴定[J]. 植物保护学报, 2016, 43(2): 233. DOI: 10.13802/j.cnki.zwbhxb.2016.02.008. -
期刊类型引用(0)
其他类型引用(1)



 下载:
下载: