四川猪传染性胸膜肺炎放线杆菌耐药基因流行规律与表型相关性研究
-
关键词:
- 猪传染性胸膜肺炎放线杆菌 /
- 分离鉴定 /
- 耐药表型 /
- 耐药基因
Study on the Epidemiology Regularity and Phenotype Correlation of Drug-resistant Genes of Infectious Actinobacillus pleuropneumoniae in Sichuan
-
艳山姜 (Alpinia zerumbet)为姜科 (Zingiberaceae)山姜属(Alpinia)植物,别名玉桃、大良姜、假砂仁、土砂仁等,广泛分布于中国东南部至西南部各地,是治理石漠化的重要经济植物,也是民间常用的香料植物资源[1-2]。艳山姜作为一种重要的中药材,其干燥成熟果实是贵州少数民族的常用药材之一[3]。有文献记载:以新鲜或干燥成熟的艳山姜果实入药,具有行气止痛、温中燥湿和截疟等功效,主治消化不良、心腹冷痛、胸腹胀满、呕吐腹泻和疟疾等病症[4]。艳山姜主要化学成分为挥发油类和黄酮类[5],现代药理研究结果表明:艳山姜具有抗菌[6]、抗氧化[7]、抗炎镇痛[8]、杀虫驱虫[9]、抗癌[10]和神经保护[11]等活性。目前,国内外对艳山姜的研究主要集中于挥发油及其活性方面,对其他具体化合物研究较少。为进一步开发艳山姜的药用价值,明确其活性物质基础,本研究对艳山姜果实进行系统的化学成分分析。
1. 材料与方法
1.1 试验材料
艳山姜果实由云南恩和生物有限公司提供,并由云南农业大学烟草学院徐俊驹教授鉴定。
1.2 试验方法
1.2.1 艳山姜果实化学成分提取
取干燥的艳山姜果实24 kg,经粉碎机粉碎,放入80 L的渗透桶中,倒入甲醇溶液50 L浸泡10 h,减压蒸馏,反复提取8次,得到粗提物5 kg。将粗提物溶于蒸馏水中,用乙酸乙酯反复萃取10余次,回收乙酸乙酯后得到萃取物2 kg。
1.2.2 艳山姜果实化学成分分离纯化
用石油醚和丙酮按体积比 (50∶1、30∶1、20∶1、10∶1、8∶2、7∶3、6∶4和1∶1)对乙酸乙酯层萃取物进行硅胶柱色谱分离,梯度洗脱,得到10个组分 (F1~ F10)。
F6经硅胶柱色谱[ 石油醚∶乙酸乙酯 (50∶1~8∶2)]梯度洗脱,得到12个组分 (F6.1~ F6.12);F6.6经硅胶柱色谱[ 石油醚∶乙酸乙酯 (30∶1~8∶2)]梯度洗脱,得到8个组分 (F6.6.1~ F6.6.8);F6.6.4经硅胶柱色谱[ 石油醚∶乙酸乙酯 (30∶1~10∶1)]梯度洗脱后,得到5个组分 (F6.6.4.1~F6.6.4.5);F6.6.4.5经制备型薄层色谱[ 石油醚∶乙酸乙酯 (20∶1)]分离后,得到化合物4 (0.5 g);F6.6.5经制备型薄层色谱[ 石油醚∶乙酸乙酯 (20∶1)]分离后,再利用HPLC [ 甲醇∶水 (8∶2~1∶0)]梯度洗脱,得到化合物1 (4.0 mg);F6.6.6经制备型薄层色谱[ 石油醚∶乙酸乙酯 (10∶1)]分离后,再经HPLC [ 甲醇∶水 (8.5∶1.5~1∶0)]梯度洗脱,得到化合物2 (4.5 mg);F6.6.7经制备型薄层色谱[ 石油醚∶丙酮 (20∶1)]分离后,再经HPLC [ 甲醇∶水 (8∶2~1∶0)]梯度洗脱,得到化合物3 (5.0 mg)。
F7经硅胶柱色谱[ 石油醚∶丙酮 (30∶1~6∶4)]梯度洗脱,得到10个组分 (F7.1~ F7.10);F7.6经硅胶柱色谱[ 石油醚∶乙酸乙酯 (20∶1~6∶4)]梯度洗脱,得到9个组分 (F7.6.1~F7.6.9);F7.6.8经硅胶柱色谱[ 石油醚∶丙酮 (10∶1~6∶4)]分离后,得到4个组分 (F7.6.8.1~F7.6.8.4);F7.6.8.3中有白色片状固体析出,过滤后,采用制备型薄层色谱[ 乙酸乙酯∶二氯甲烷 (8∶2)]分离,得到化合物5 (0.45 g)。
F8经硅胶柱色谱[ 石油醚∶丙酮 (30∶1~6∶4)]梯度洗脱,得到10个组分 (F8.1~F8.10);F8.8经硅胶柱色谱[ 石油醚∶乙酸乙酯 (20∶1~6∶4)]梯度洗脱,得到9个组分 (F8.8.1~F8.8.9);F8.8.6经硅胶柱色谱[ 石油醚∶丙酮 (10∶1~6∶4)]分离后,得到4个组分 (F8.8.6.1~F8.8.6.4);F8.8.6.3中有大量白色晶体析出,通过重结晶,得到化合物6 (5.4 g)。
F9经硅胶柱色谱[ 石油醚∶丙酮 (10∶1~1∶2)]梯度洗脱,得到9个组分 (F10.1~F10.9)。在F10.6中发现有无色透明方块晶体析出,用甲醇洗脱过滤,再用丙酮洗脱过滤,得到透明方晶,然后用二氯甲烷溶解方晶,再通过重结晶,得到化合物7 (3 g)。
1.2.3 艳山姜果实化学成分鉴定
运用13C NMR、1H NMR和ESI-MS光谱分析方法对所得化合物进行结构鉴定,化合物1~7结构如图1。
2. 结果与分析
化合物1:无色油状物,C24H38O4,ESI-MS m/z:391[M+H]+。1H NMR (800 MHz, CDCl3, δ, J/Hz): 7.71 (2H, dd, J=7.2, 4.0, H-3, 6), 7.53 (2H, dd, J=7.2, 4.0, H-4, 5), 4.25~4.19 (4H, m, H-1 ′, 1 ″), 1.68 (2H, m, H-2′, 2″), 1.33~1.25 (16H, m, H-3′, 3″, 4′, 4″, 5′, 5″, 7′, 7″), 0.90 (6H, t, J=7.2, H-6′, 6″), 0.92 (6H, t, J=7.2, H-8′, 8″); 13C NMR (200 MHz, CDCl3, δ): 167.8 (s, 2×COO), 132.5 (s, C-1, 2), 128.8 (d, C-3, 6), 130.9 (d, C-4, 5), 68.2 (t, C-1 ′, 1 ″), 38.7 (d, C-2′, 2″), 30.4 (t, C-3′, 3″), 28.9 (t, C-4′, 4″), 23.0 (t, C-5′, 5″), 14.1 (q, C-6′, 6″), 23.8 (t, C-7′, 7″), 11.0 (q, C-8′, 8″)。以上波谱数据与文献[12-13]报道基本一致,故鉴定该化合物为bis (2-ethylhexyl) benzene-1, 2- dicarboxylate。
化合物2:无色油状物,C24H38O4。1H NMR (600 MHz, CDCl3, δ, J/Hz): 8.09 (4H, s, H-2, 3, 5, 6), 4.27 (4H, m, H-1′, 1′′), 1.75 (2H, m, H-2′, 2′′), 1.50 ~1.30 (16H, m, H-3′, 3′′, 4′, 4′′, 5′, 5′′, 7′, 7′′), 0.90 (6H, t, J=7.0, H-6′, 6′′), 0.95 (6H, t, J=7.5, H-8′, 8′′); 13C NMR (150 MHz, CDCl3, δ): 166.0 (s, 2×COO), 134.2 (s, C-1, 4), 129.5 (d, C-2, 3, 5, 6), 67.7 (t, C-1′, 1′′), 38.9 (d, C-2′, 2′′), 30.6 (t, C-3′, 3′′), 29.0 (t, C-4′, 4′′), 23.0 (t, C-5′, 5′′), 14.0 (q, C-6′, 6′′), 24.0 (t, C-7′, 7′′), 11.0 (q, C-8′, 8′′)。以上波谱数据与文献[14-15]报道基本一致,故将该化合物鉴定为terephthalic acid bis (2-ethylhexyl) ester。
化合物3:无色油状物,C16H22O4,ESI-MS m/z:279 [M+H]+。1H NMR (800 MHz, CDCl3, δ, J/Hz): 7.72 (2H, dd, J=5.6, 3.2, H-3, 6), 7.53 (2H, dd, J=5.6, 3.2, H-4, 5), 4.31 (4H, t, J=6.4, H-8, 8′), 1.74~1.70 (4H, m, H-9, 9′), 1.47~1.42 (4H, m, H-10, 10 ′), 0.96 (6H, t, J=7.2, H-11, 11 ′); 13C NMR (200 MHz, CDCl3, δ): 132.3 (s, C-1, 2), 128.9 (d, C-3, 6), 131.0 (d, C-4, 5), 167.7 (s, C-7, 7′), 65.6 (t, C-8, 8′), 30.7 (t, C-9, 9′), 19.2 (t, C-10, 10′), 13.7 (q, C-11, 11′)。以上波谱数据与文献[16]报道基本一致,故鉴定该化合物为dibutyl phthalate。
化合物4:黄色油状物,C30H58O2,ESI-MS m/z:451[M+H]+。1H NMR (600 MHz, CDCl3, δ, J/Hz): 5.36~5.33 (2H, m, H-11, 12), 2.36 (2H, m, H-10), 2.35 (2H, t, J=7.5, H-2), 2.02 (2H, m, H-13), 1.63 (4H, m, 2×CH2), 1.31 (16H, br s, 8×CH2), 1.29 (14H, br s 7×CH2), 1.25 (12H, br s, 6×CH2), 0.88 (3H, t, J=6.9, H-30); 13C NMR (150 MHz, CDCl3, δ): 180.3 (s, C-1), 129.7 (d, C-11), 130.0 (d, C-12), 34.1 (t), 31.9 (t, 2×CH2), 29.7 (t, 14×CH2), 29.6 (t), 29.4 (t), 29.3 (t), 29.2 (t), 29.0 (t), 27.2 (t), 27.1 (t), 24.7 (t), 22.7 (t), 14.1 (q, C-30)。 以上波谱数据与文献[17]报道基本一致,故将该化合物鉴定为n-triacont-11-enoic acid。
化合物5:白色片状晶体,C29H48O。1H NMR (600 MHz, CDCl3, δ, J/Hz): 3.52 (1H, m, H-3), 2.28 (2H, m, H-4), 5.35 (1H, m, H-6), 0.70 (3H, d, J=7.3, H-18), 1.02 (3H, s, H-19), 0.92 (3H, d, J=6.5, H-21), 5.16 (1H, dd, J=15.2, 8.8, H-22), 5.02 (1H, dd, J=15.2, 8.8, H-23), 0.84 (3H, t, J=7.2, H-29); 13C NMR (150 MHz, CDCl3, δ): 37.2 (t, C-1), 31.9 (t, C-2), 71.8 (d, C-3), 42.3 (t, C-4), 140.7 (s, C-5), 121.7 (d, C-6), 33.9 (t, C-7), 31.6 (d, C-8), 50.1 (d, C-9), 36.1 (s, C-10), 21.1 (t, C-11), 39.7 (t, C-12), 42.3 (s, C-13), 56.7 (d, C-14), 24.3 (t, C-15), 28.2 (t, C-16), 56.0 (d, C-17), 11.8 (s, C-18), 18.8 (s, C-19), 39.7 (d, C-20), 23.0 (s, C-21), 138.3 (d, C-22), 129.2 (d, C-23), 45.8 (d, C-24), 29.1 (d, C-25), 19.8 (s, C-26), 19.4 (s, C-27), 26.0 (t, C-28), 12.0 (s, C-29)。以上波谱数据与文献[18]报道基本一致,故鉴定该化合物为豆甾醇。
化合物6:白色针状晶体,C14H14O3,ESI-MS m/z:231[M+H]+。1H NMR (600MHz, CDCl3, δ, J/Hz): 5.41 (1H, d, J=2.0, H-3), 5.72 (1H, d, J=1.9, H-5), 2.75 (2H, t, J=8.0, H-7), 2.97 (2H, t, J=7.6, H-8), 7.29~7.16 (5H, m, H-10, 11, 12, 13, 14), 3.75 (3H, s, 4-OCH3); 13C NMR (150 MHz, CDCl3, δ): 171.0 (s, C-2), 87.5 (d, C-3), 164.7 (s, C-4), 100.1 (d, C-5), 164.1 (d, C-6), 32.6 (t, C-7), 35.2 (t, C-8), 139.7 (s, C-9), 126.2 (d, C-10, 14), 128.1 (d, C-11, 13), 128.4 (d, C-12), 55.6 (q, 4-OCH3)。以上波谱数据与文献[19]报道基本一致,故鉴定该化合物为dihydro-5,6-dehydrokawain。
化合物7:无色针状晶体,C28H24O6,ESI-MS m/z:456[M]+。1H NMR (600 MHz, CDCl3, δ, J/Hz): 5.34 (1H, d, J=2.1, H-3), 5.92 (1H, d, J=2.0, H-5), 4.17 (1H, d, J=11.0, H-7), 4.36 (1H, dd, J=12.0, 6.0, H-8), 3.71 (3H, s, 4-OCH3), 5.30 (1H, s, H-3′), 3.60 (1H, d, J=9.8, H-5′), 6.60 (1H, d, J=15.8, H-7′), 6.95 (1H, d, J=15.8, H-8′), 3.28 (3H, s, 4′-OCH3), 7.43~7.24 (10H, m)是2个苯环上的氢信号。13C NMR (150 MHz, CDCl3, δ): 164.6 (s, C-2), 91.8 (d, C-3), 170.5 (s, C-4), 102.7 (d, C-5), 158.6 (s, C-6), 45.7 (d, C-7), 54.5 (d, C-8), 135.8 (s, C-9), 127.5 (d, C-10), 128.4 (d, C-11), 128.2 (d, C-12), 128.4 (d, C-13), 127.5 (d, C-14), 55.9 (q, C-15), 163.9 (s, C-2′), 88.7 (d, C-3′), 169.9 (s, C-4′), 39.1 (d, C-5′), 79.4 (s, C-6′), 124.3 (d, C-7′), 131.4 (d, C-8′), 135.6 (s, C-9′), 126.8 (d, C-10′), 128.4 (d, C-11′), 127.8 (d, C-12′), 128.4 (d, C-13′), 126.8 (d, C-14′), 55.4 (q, C-15′)。以上波谱数据与文献[20]报道基本一致,故鉴定该化合物为aniba dimer A。
3. 讨论
艳山姜作为特色民族药材,国内外对其均有研究,但主要集中于艳山姜挥发油的成分及活性方面,对艳山姜果实的化学成分研究较少。在分离过程中发现:艳山姜果实中小极性物质较多,很多成分难以分离纯化,因此,本研究主要集中于中等极性成分的分离和鉴定,从中得到7个化合物,其中dihydro-5,6-dehydrokawain含量较高,有研究表明:该化合物能拮抗实验性胃及十二指肠溃疡,对花生四烯酸和胶原引起的家兔血小板聚集具有明显的拮抗作用,抑制ATP释放[21]。在本研究的基础上,将对艳山姜果实化学成分以及生物活性展开进一步研究,为深度开发和利用艳山姜提供一定的数据支持。
4. 结论
利用正相硅胶柱色谱、薄层层析色谱和HPLC分离手段对艳山姜果实化学成分进行分离纯化,得到7个化合物。其中,化合物bis (2-ethylhexyl) benzene-1,2-dicarboxylate (1)、terephthalic acid bis (2-ethylhexyl) ester (2)、dibutyl phthalate (3)和n-triacont-11-enoic acid (4)为首次从艳山姜果实中分离得到。
-
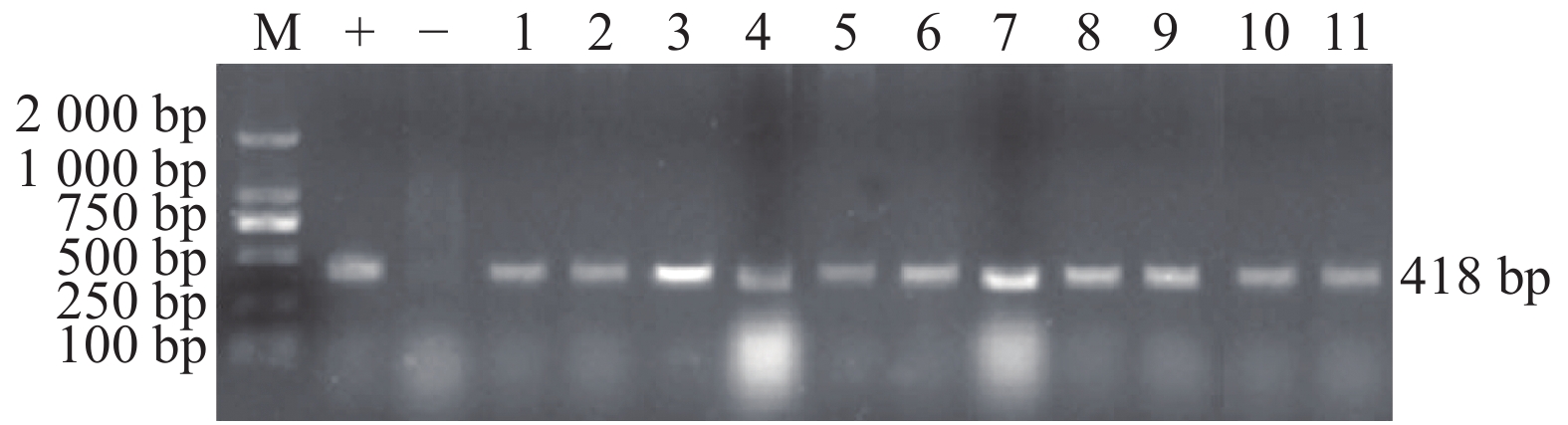
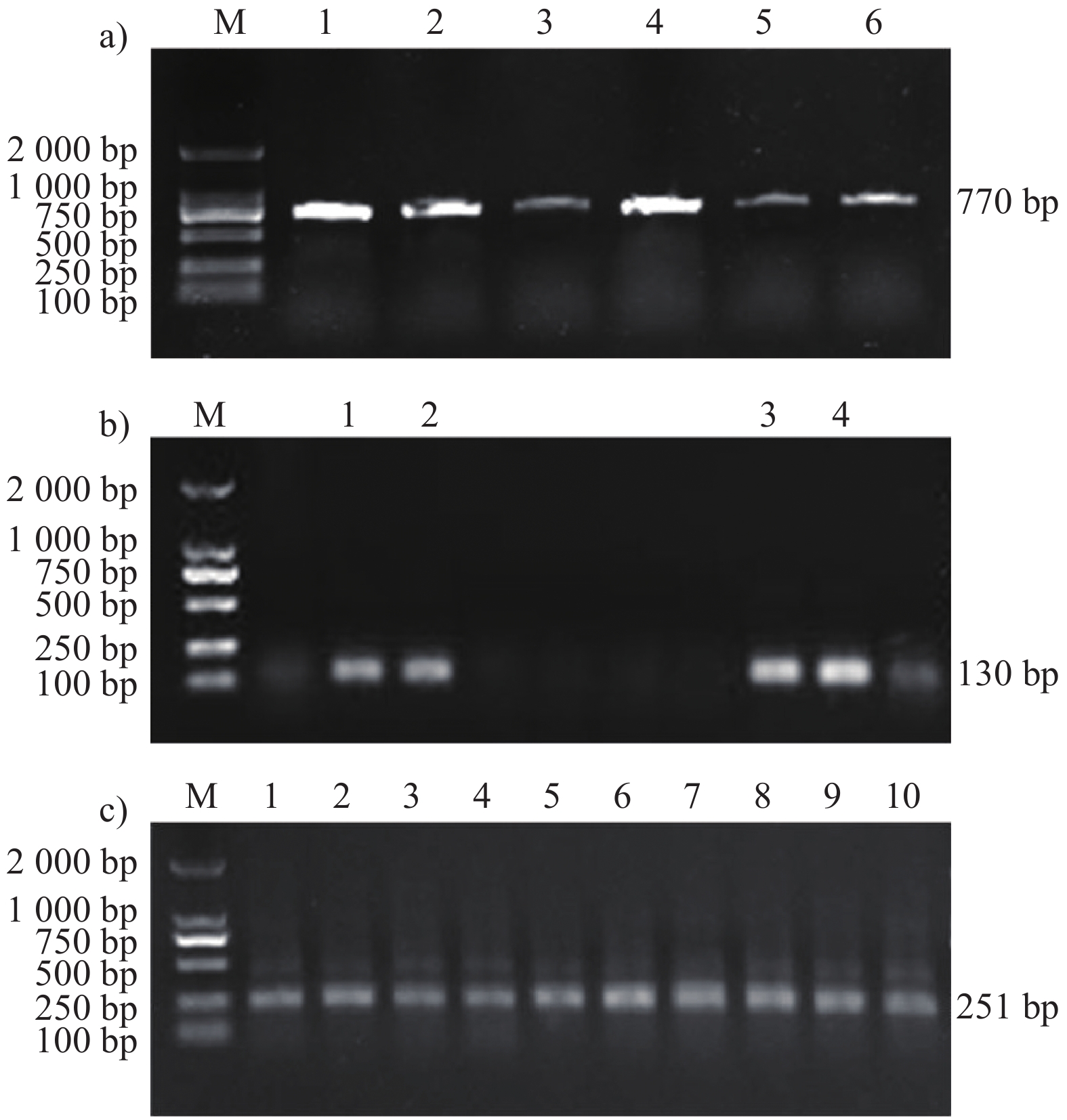
图 5 耐药基因的PCR扩增结果
注:a) M. DL2000,1~6. sul3目的基因扩增产物;b) M. DL2000,1~4. tetB目的基因扩增产物;c) M. DL2000,1~10. tetC目的基因扩增产物。
Figure 5. PCR amplification results of drug resistance genes
Note: a) M. DL2000, 1-6. sul3 target gene amplification product; b) M. DL2000, 1-4. tetB target gene amplification product; c) M. DL2000, 1-10. tetC target gene amplification product.
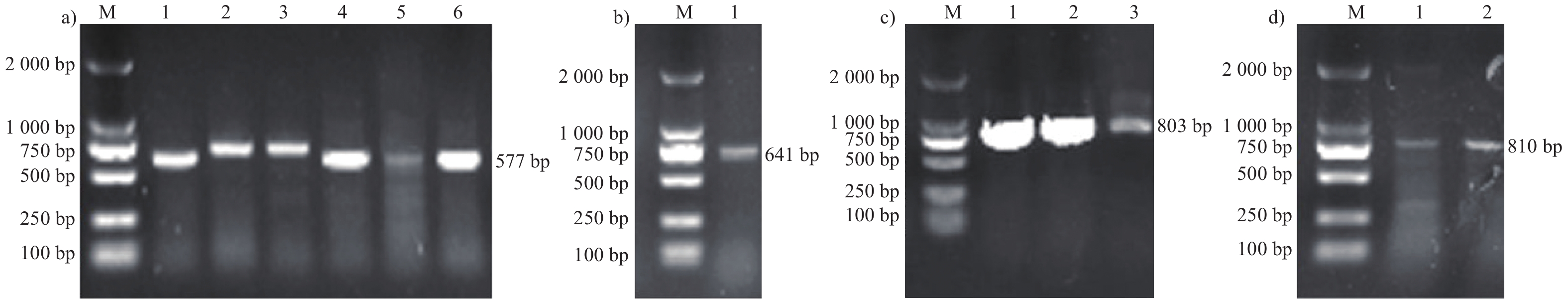
图 6 耐药基因的PCR扩增结果
注:a) M. DL2000,1~6. ant(6')-Ia目的基因扩增产物;b) M. DL2000,1. aph(2'')-Id目的基因扩增产物;c) M. DL2000,1~3. floR目的基因扩增产物;d) M. DL2000,1~2. ermB目的基因扩增产物。
Figure 6. PCR amplification result of resistant genes
Note: a) M. DL2000, 1-6. ant(6')-Ia target gene amplification product; b) M. DL2000, 1. aph(2'')-Id target gene amplification product; c) M. DL2000, 1-3. floR target gene amplification product; d) M. DL2000, 1-2. ermB target gene amplification product.
表 1 耐药基因引物序列
Table 1 The primer sequences of dug-resistant genes
基因
genes引物序列(5′→3′)
primer sequences产物大小/bp
product size退火温度/℃
annealing temperature参考文献
referencesmefA F: CAATATGGGCAGGGCAAG 317 60 [9] R: AAGCTGTTCCAATGCTACGG ermA F: CCCGAAAAATACGCAAAATTTCAT 590 R: CCCTGTTTACCCATTTATAAACG ermB F: TGGTATTCCAAATGCGTAATG 810 R: CTGTGGTATGGCGGGTAAGT sul1 F: GTGACGGTGTTCGGCATTCT 780 56 [10] R: CTAACCTAGGGCTTTGGA sul2 F: GAGCAAGATTTTTGGAATCG 720 R: TCCGAGAAGGTGATTGCGCT sul3 F: TGTGCGGATGAAGTCAGCTC 770 R: CGGCATCGTCAACATAACCT aac(6')-Ie-aph(2'')-Ia F: CAGGAATTTATCGAAAATGGTAGAAAAG 369 56 [11] R: CACAATCGACTAAAGAGTACCAATC aph(3'')-IIIa F: GGCTAAAATGAGAATATCACCGG 523 R: CTTTAAAAAATCATACAGCTCGCG ant(6')-Ia F: ACTGGCTTAATCAATTTGGG 577 R: GCCTTTCCGCCACCTCACCG aph(2'')-Ib F: CTTGGACGCTGAGATATATGAGCAC 867 R: GTTTGTAGCAATTCAGAAACACCCTT aph(2'')-Ic F: CCACAATGATAATGACTCAGTTCCC 444 R: CCACAGCTTCCGATAGCAAGAG aph(2'')-Id F: GTGGTTTTTACAGGAATGCCATC 641 R: CCCTCTTCATACCAATCCATATAACC tetA F: CATAGATCGCCGTGAAGAGG 210 62 [12] R: GCTACATCCTGCTTGCCTTC tetB F: TTTGCCTTTTTAGCGTTT 130 52 — R: GCACCTTGCTGATGACTC tetC F: TCTAACAATGCGCTCATCGT 251 62 [13] R: GGTTGAAGGCTCTCAAGGGC tetM F: ACAGAAAGCTTATTATATAAC 171 55 R: TGGCGTGTCTATGATGTTCAC tetX F: CAATAATTGGTGGTGGACCC 468 60 [14] R: TTCTTACCTTGGACATCCCG floR F: CCCGCTATGATCCAACTCAC 803 59 [15] R: ACCCACATCGGTAGGATGAA cat1 F: AGTTGCTCAATGTACCTATAACC 547 51 [16] R: TTGTAATTCATTAAGCATTCTGCC cmlA F: CCGCCACGGTGTTGTTGTTATC 698 56 R: CACCTTGCCTGCCCATCATTAG 注:—. 本实验设计引物。
Note: —. primers designed by this study.表 2 11株APP分离株的生化鉴定结果
Table 2 Biochemical identification results of 11 APP isolates
生化试验项目
biochemical test project临床分离株编号 clinical isolates No. SC1801 SC1802 SC1803 SC1804 SC1805 SC1806 SC1807 SC1808 SC1809 SC1810 SC1811 葡萄糖 glucose + + + + + + + + + + + 乳糖 lactose - - - - - - - - - - - 果糖 fructose + + + + + + + + + + + 甘露醇 mannitol - + + + - - + - + + - 山梨醇 sorbitol - - - - - - - - - - - 氧化酶 oxidase + + + + + + + + + + + 尿素酶 urease + + + + + + + + + + + 过氧化氢酶 catalase + + + + + + + + + + + 硝酸盐还原酶 nitrate reductase + + + + + + + + + + + VP - - - - - - - - - - - 注:+. 阳性;-. 阴性。氧化酶为弱阳性。
Note:+. positive; -. negative. Oxidase was weakly positive.表 3 APP临床分离株的药物敏感性
Table 3 Antimicrobial susceptibility of APP clinical isolates
抗菌药物
antibacterial agents敏感
susceptible中度
intermediate耐药
resistant耐药率/%
resistance rate氨苄西林
ampicillin11 0 0 0 阿莫西林
amoxicillin11 0 0 0 头孢氨苄
cefalexin11 0 0 0 头孢曲松
ceftriaxone11 0 0 0 红霉素
erythrocin10 0 1 9.10 盐酸克林霉素
clindamycin8 0 3 27.27 盐酸林可霉素
lincomycin4 1 6 54.55 复方新诺明
cotrimoxazole4 1 6 54.55 链霉素
streptomycin5 0 6 54.55 庆大霉素
gentamicin8 0 3 27.27 卡那霉素
kanamycin7 2 2 18.18 四环素
tetracycline1 0 10 90.90 多西环素
doxycycline1 0 10 90.90 氯霉素
chloramphenicol8 0 3 27.27 氟苯尼考
florfenicol8 0 3 27.27 诺氟沙星
norfloxacin11 0 0 0 环丙沙星
ciprofloxacin11 0 0 0 萘啶酸
nalidixic acid11 0 0 0 表 4 11株分离株耐药谱和耐药基因携带情况
Table 4 Drug resistance spectrum and resistance genes carrying status of 11 isolates
菌株 strains 耐药谱 drug resistant spectrum 耐药基因 drug resistance genes SC1801 STR-TE-DOX ant(6')-Ia-tetC SC1802 MH-CM-SMZ-TE-DOX ermB-sul3-tetC SC1803 STR ant(6')-Ia SC1804 MH-CM-SMZ-SM-TE-DOX sul3-aac(6')-Ie-aph(2'')-Ia-tetC SC1805 SMZ-GEN-KAN-TE-DOX sul3-ant(6')-Ia-tetC SC1806 TE-DOX tetB-tetC SC1807 TE-DOX tetB-tetC SC1808 MH-TE-DOX tetC SC1809 EM-MH-CM-SMZ-STR-GEN-TE-DOX-CL-FFC ermB-sul3-ant(6')-Ia-aph(2'')-Id-tetC-floR SC1810 MH-SMZ-STR-GEN-KAN-TE-DOX-CL-FFC sul3- ant(6')-Ia-tetB-tetC-floR SC1811 MH-SMZ-STR-TE-DOX-CL-FFC sul3-ant(6')-Ia-tetB-tetC-floR 注:EM. 红霉素;MH. 盐酸林可霉素;CM. 盐酸克林霉素;SMZ. 复方新诺明;STR. 链霉素;GEN. 庆大霉素;KAN. 卡那霉素;TE. 四环素;DOX. 多西环素;CL. 氯霉素;FFC. 氟苯尼考。
Note: EM. erythrocin; MH. lincomycin hydrochloride; CM. clindamycin; SMZ. trimethoprim sulfamethoxazole; STR. streptomycin; GEN. gentamicin; KAN. kanamycin; TE. tetracycline; DOX. doxycycline; CL. chloramphenicol; FFC. florfenicol. -
[1] BETH C, LUCA A P, GAVIN B S, et al. Consumer attitudes towards production diseases in intensive production systems[J]. PLoS One, 2019, 14(1): 179. DOI: 10.1371/journal.pone.0210432.
[2] POHL S, BERTSCHINGER H U, FREDERIKSEN W, et al. Transfer of Haemophilus pleuropneumoniae and the pasteurella haemolytica-like organism causing porcine necrotic pleuropneumonia to the genus actinobacillus (Actinobacillus pleuropneumoniae comb. nov.) on the basis of phenotypic and deoxyribonucleic acid relatedness[J]. International Journal of Systematic Bacteriology, 1983, 33(3): 512. DOI: 10.1099/00207713-33-3-510.
[3] DAO H T, TRUONG Q L, DO V T, et al. Construction and immunization with double mutant deltaapxIbd deltapnp forms of Actinobacillus pleuropneumoniae serotypes 1 and 5[J]. Journal of Veterinary Science, 2020, 21(2): e20. DOI: 10.4142/jvs.2020.21.e20.
[4] BOSSÉ J T, LI Y W, SÁRKÖZI R, et al. Proposal of serovars 17 and 18 of Actinobacillus pleuropneumoniae based on serological and genotypic analysis[J]. Veterinary Microbiology, 2018, 217: 1. DOI: 10.1016/j.vetmic.2018.02.019.
[5] 徐引弟, 王治方, 张青娴, 等. 1型传染性胸膜肺炎放线杆菌的分离鉴定及生物学特性[J]. 山西农业科学, 2019, 47(3): 433. DOI: 10.3969/j.issn.1002-2481.2019.03.31. [6] 郑培, 张飞, 贺笋. 猪传染性胸膜肺炎放线杆菌血清5型的分离鉴定[J]. 现代畜牧兽医, 2019(6): 9. [7] 许金朋. 胸膜肺炎放线杆菌转录组学及yajC基因缺失株的生物学特性研究[D]. 北京: 中国农业科学院, 2018. [8] 刘玉庆, 李璐璐, 骆延波, 等. EUCAST欧盟药敏试验标准[J]. 中国标准导报, 2016(5): 60. [9] MALHOTRA-KUMAR S, LAMMENS C, PIESSENS J, et al. Multiplex PCR for simultaneous detection of macrolide and tetracycline resistance determinants in streptococci[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(11): 4798. DOI: 10.1128/AAC.49.11.4798-4800.2005.
[10] 李海利, 邓祖丽颖, 徐引弟, 等. 猪传染性胸膜肺炎放线杆菌磺胺类药物耐药基因的检测[J]. 河南农业科学, 2016, 45(5): 135. DOI: 10.15933/j.cnki.1004-3268.2016.05.027. [11] NIU H Y, YU H, HU T P, et al. The prevalence of aminoglycoside-modifying enzyme and virulence genes among enterococci with high-level aminoglycoside resistance in Inner Mongolia, China[J]. Brazilian Journal of Microbiology, 2016, 47(3): 691. DOI: 10.1016/j.bjm.2016.04.003.
[12] 王学君, 谭艾娟, 吕世明, 等. 贵州省猪源大肠杆菌对四环素类药物的耐药性及耐药基因检测[J]. 中国畜牧兽医, 2018, 45(5): 1367. DOI: 10.16431/j.cnki.1671-7236.2018.05.030. [13] 刘竟雅, 侯晓昱, 吴金燕, 等. 貉源大肠杆菌四环素耐药基因的检测[J]. 野生动物学报, 2020, 41(2): 500. DOI: 10.3969/j.issn.1000-0127.2020.02.033. [14] 白龙, 邵毅, 黄柳娟, 等. 鸡源细菌中5种四环素耐药基因多重PCR检测方法的建立[J]. 食品与机械, 2018, 34(10): 55. DOI: 10.13652/j.issn.1003-5788.2018.10.011. [15] SILVA N C S L, NOGUEIRA J F, GOUVEIA J J S, et al. Gene floR and resistance to florfenicol in isolated Aeromonas spp. indigenous aquatic organisms[J]. Brazilian Journal of Veterinary Research, 2018, 38(3): 357. DOI: 10.1590/1678-5150-pvb-4842.
[16] 赵凤菊, 关淼, 李清竹, 等. 猪源大肠埃希菌氯霉素类抗生素主要耐药基因的检测与分析[J]. 动物医学进展, 2017, 38(7): 50. DOI: 10.3969/j.issn.1007-5038.2017.07.011. [17] ŽUTIĆ J, PAVLOVIĆ L, RADANOVIĆ O, et al. Antimicrobial susceptibility of Actinobacillus pleuropneumoniae strains isolated from pig ’s clinical samples in Serbia[J]. Medycyna Weterynaryjna, 2016, 72(10): 637. DOI: 10.21521/mw.5570.
[18] SWEENEY M T, LINDEMAN C, JOHANSEN L, et al. Antimicrobial susceptibility of Actinobacillus pleuropneumoniae, Pasteurella multocida, Streptococcus suis, and Bordetella bronchiseptica isolated from pigs in the United States and Canada, 2011 to 2015[J]. Journal of Swine Health & Production, 2017, 25(3): 109.
[19] KIM B, HUR J, LEE J Y, et al. Molecular serotyping and antimicrobial resistance profiles of Actinobacillus pleuropneumoniae isolated from pigs in South Korea[J]. Veterinary Quarterly, 2016, 36(3): 137. DOI: 10.1080/01652176.2016.1155241.
[20] KAMIMURA S, SAMESHIMA T, ITO H. Serovar and antimicrobial resistance profiles of actinobacillus pleuropneumoniae isolated in japan from 2006 to 2011[J]. Japan Agricultural Research Quarterly, 2016, 50(1): 73. DOI: 10.6090/jarq.50.73.
[21] DAYAO D, GIBSON J S, BLACKALL P J, et al. Antimicrobial resistance genes in Actinobacillus pleuropneumoniae, Haemophilus parasuis and Pasteurella multocida isolated from Australian pigs[J]. Australian Veterinary Journal, 2016, 94(7): 227. DOI: 10.1111/avj.12458.
[22] 张东超, 杨宁宁, 林静, 等. 猪传染性胸膜肺炎放线杆菌的分离鉴定及药敏试验[J]. 中国畜牧兽医, 2016, 43(6): 1604. DOI: 10.16431/j.cnki.1671-7236.2016.06.031. [23] 李海利, 朗利敏, 徐引弟, 等. 猪传染性胸膜肺炎放线杆菌的分离与鉴定及药敏试验[J]. 黑龙江畜牧兽医, 2015(19): 179. DOI: 10.13881/j.cnki.hljxmsy.2015.1793. [24] 袁芳艳, 刘泽文, 周丹娜, 等. 猪场胸膜肺炎放线杆菌分离鉴定、血清型鉴定及药敏试验[J]. 黑龙江畜牧兽医, 2017(22): 109. DOI: 10.13881/j.cnki.hljxmsy.2017.1891. [25] 廖晓糠, 汤德元, 石远菊, 等. 猪胸膜肺炎放线杆菌的分离鉴定和药敏试验[J]. 贵州畜牧兽医, 2018, 42(3): 14. DOI: 10.3969/j.issn.1007-1474.2018.03.005. [26] 张尤贞, 颜秀梅, 汤春莲, 等. 头孢喹肟对胸膜肺炎放线杆菌的药动/药效学研究[J]. 安徽农业科学, 2018, 46(12): 99. DOI: 10.3969/j.issn.0517-6611.2018.12.030. [27] 李凯明, 董发明, 刘守川, 等. 洛阳某猪场猪传染性胸膜肺炎放线杆菌的分离鉴定[J]. 中国畜牧兽医, 2020, 47(4): 1245. DOI: 10.16431/j.cnki.1671-7236.2020.04.031. -
期刊类型引用(1)
1. 韦凤超,玉焕,植春婷,梁子宁,许立拔. 香砂纯露对酵母所致发热大鼠解热作用的可行性分析. 壮瑶药研究. 2023(01): 169-173 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: