鲫鱼基因组DNA的扩增及在SSR分析中的验证
Increase of Genomic DNA with Verification by SSR Analysis in Carp Carassius auratus
-
Keywords:
- Carassius auratus /
- genomic DNA /
- PCR /
- microsatellite /
- endonuclease
-
据统计,全世界约有39.5亿hm2的酸性土壤,其中可耕地面积约为1.79亿hm2,大部分分布在热带、亚热带及温带地区[1]。中国酸性土壤的分布遍及15个省区,总面积达203万hm2,约占中国耕地面积的21%[2]。当土壤pH值低于5.5时,土壤中的高活性铝含量增加,严重制约了植物的生长发育,铝毒害是酸性土壤中植物生长发育的主要限制因子[3]。
楚雄南苜蓿(Medicago hispida cv. Chuxiong)是豆科苜蓿属一年生或越年生草本植物,在云南省楚雄州禄丰县已推广种植60年以上,是冬春季种植的优良豆科牧草,具有饲用价值高、固氮能力强、耐旱、耐酸铝等特点,是酸性土壤上可种植的优质豆科牧草之一。随着畜牧业的大力发展,优质豆科牧草的重要作用已引起高度重视。苜蓿作为主要的豆科牧草在北方种植面积较大,在南方因为土壤偏酸性其栽培受到了限制,不能满足畜牧业的均衡发展。作为云南省地方品种,楚雄南苜蓿已有60多年的栽培种植历史,在酸性土壤中生长发育良好,但是目前对楚雄南苜蓿的研究主要集中在种子产量[4]、生长特性[5-6]和高产栽培等方面。因此,本试验对楚雄南苜蓿在不同酸、铝胁迫条件下的萌发特性进行深入研究,观察发芽相关指标和根长、茎长及其生理指标的变化,以期发现其对酸、铝作用的规律,为酸性土壤中苜蓿的改良和栽培提供理论依据和参考。
1. 材料与方法
1.1 供试材料
1.1.1 种子
供试种子为楚雄南苜蓿,由云南省楚雄州禄丰县彩云镇兽医站提供。
1.1.2 化学试剂
用0.1 mol/L NaOH、0.1 mol/L HCl、六水氯化铝和蒸馏水配制出30种溶液以供试验。
1.2 方法
1.2.1 胁迫处理
本试验设置5个pH水平,6个Al3+质量浓度,共计30个胁迫处理,具体见表1。
表 1 不同pH值和Al3+质量浓度胁迫处理Table 1. Different pH values and Al3+ mass concentrations stress treatmentspH ρ(Al3+)/(mg·L−1) 3.5 0 100 300 500 700 1 000 4.5 0 100 300 500 700 1 000 5.5 0 100 300 500 700 1 000 6.5 0 100 300 500 700 1 000 7.5 0 100 300 500 700 1 000 1.2.2 种子萌发试验
本试验于2018年4月在云南农业大学草业科学实验室进行。挑选饱满且健康的种子,75%乙醇消毒后用蒸馏水反复冲洗干净,置于铺有3层滤纸,且滴加等量(20 mL)培养液(对应pH值和Al3+质量浓度)的干净培养皿中,保持基质湿润,每个处理3次重复,每个重复50粒种子。将培养皿置于25 ℃恒温,16/8 h的光照培养箱中培养。
1.2.3 指标测量
每天观察种子发芽以及幼苗生长情况,记录发芽种子数,发芽率按10 d计算,所用方法如下[7]:
发芽率(GR)=∑Gt/T×100%;
发芽势(GP)=∑Gt′/T×100%;
发芽指数(GI)=∑Gt/Dt;
活力指数(VI)=GI×S。
式中,Gt为10 d内的发芽数;T为供试种子数;Gt′为前4 d内发芽数;Dt为发芽的日数;S为单株幼苗平均鲜重。
根长和茎长测定:发芽第10天,从每个培养皿随机挑出10株进行测量、称重,计算平均值。将长出真叶的幼苗移栽至1 L的塑料瓶中(去掉上半部),用Hoagland培养液培养(调整至对应的pH值和Al3+质量浓度),通气泵进行通气,每天2次,每次通气4 h。10 d后选取长势一致的植株测量其丙二醛含量、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性[8]。
1.3 数据分析
用Excel 2010处理数据,SPSS 19.0进行方差分析和Duncan’s 多重比较。
2. 结果与分析
2.1 酸、铝胁迫对种子萌发的影响
由表2可知:在pH 5.5~7.5,Al3+质量浓度为0~500 mg/L条件下,楚雄南苜蓿种子发芽率较高,同时各处理间差异不显著(P>0.05)。当pH值低于4.5、Al3+质量浓度大于300 mg/L时,发芽率迅速下降,说明微酸微碱条件下,楚雄南苜蓿发芽率对铝毒害有较强的耐受性,酸性越强,种子发芽越是易受Al3+质量浓度的影响。单纯酸胁迫下,种子发芽率随着pH值的降低而降低,在pH 5.5时发芽率最高,与pH 3.5和 4.5处理间达到差异显著(P<0.05)。楚雄南苜蓿的发芽率(pH 5.5)和发芽势(pH 7.5)在Al3+质量浓度均为0 mg/L最高,在pH 3.5、Al3+质量浓度1 000 mg/L时最低。
表 2 酸、铝胁迫对种子萌发的影响Table 2. Effects of acid and aluminum stress the on seed germinationρ(Al3+)/(mg·L−1) 发芽率/% germination rate pH 3.5 pH 4.5 pH 5.5 pH 6.5 pH 7.5 0 42.00 Ab 42.57 Ab 48.00 Aa 46.00 Aab 45.33 Aab 100 40.67 Ab 42.00 Aab 43.67 Aa 44.33 ABa 45.33 Aa 300 41.00 Ab 41.33 Ab 44.60 Aa 44.20 ABa 45.00 Aa 500 30.00 Bb 34.00 Bb 44.67 Aa 44.00 ABa 44.50 ABa 700 22.50 Cb 24.00 Cb 26.00 Bab 29.50 Ba 29.00 Ba 1 000 12.00 Db 13.33 Dab 15.00 Cab 19.00 Ca 19.00 Ca ρ (Al3+)/(mg·L−1) 发芽势/% germination energy pH 3.5 pH 4.5 pH 5.5 pH 6.5 pH 7.5 0 41.50 Aa 42.65 Aa 44.67 Aa 44.67 Aa 48.67 Aa 100 41.00 Aa 40.67 ABa 42.67 Aa 42.50 Aa 42.67 Aa 300 39.00 Abc 37.33 ABc 42.67 Aa 40.00 Aabc 42.00 Aab 500 32.00 Aa 37.00 ABa 42.00 Aa 44.00 Aa 42.67 Aa 700 21.00 Bc 24.00 Cbc 24.67 Babc 29.00 Bab 20.00 Ba 1 000 12.00 Cb 13.00 Dab 14.50 Cab 18.50 Ca 18.00 Bab 注:同列比较,不同大写字母表示差异显著(P<0.05);同行比较,不同小写字母表示差异显著(P<0.05);下同。
Note: Compared with the same column, different capital letters indicate significant differences between different treatments (P<0.05); compared with the same line, different lowercase letters indicate significant differences between treatments (P<0.05); the same as below.2.2 酸、铝胁迫对幼苗生长的影响
由表3可知:茎长在Al3+质量浓度为0~500 mg/L之间的不同pH胁迫下,均无显著差异;当Al3+质量浓度达到700 mg/L时,茎长生长受到明显抑制。在pH 6.5、Al3+质量浓度为100 mg/L时茎长最长(1.56 cm),在pH 3.5、Al3+质量浓度为1 000 mg/L时最短(0.47 cm)。根长在pH 6.5、Al3+质量浓度为0 mg/L时最长(4.18 cm),在pH 3.5、Al3+质量浓度为1 000 mg/L时最短(0.48 cm)。无论哪种酸胁迫下,根长和茎长在Al3+质量浓度大于500 mg/L时均迅速下降,且根长比茎长对酸、铝胁迫更为敏感。综合来看,在pH 6.5、Al3+质量浓度为0~500 mg/L处理下,楚雄南苜蓿幼苗生长状况优于其他处理,表明微酸环境有利于楚雄南苜蓿幼苗抵御铝毒害。
表 3 酸、铝胁迫对种子幼苗生长的影响Table 3. Effects of acid and aluminum stress on the seedling growthρ(Al3+)/(mg·L−1) 茎长/cm stem length pH 3.5 pH 4.5 pH 5.5 pH 6.5 pH 7.5 0 1.07 ABb 1.12 ABb 1.18 ABb 1.54 Aa 1.45 Aa 100 1.36 Aab 1.28 Ab 1.31 Aab 1.56 Aa 1.42 Aa 300 1.02 ABa 1.01 Ba 1.05 Ba 1.04 Ba 0.92 Ba 500 0.80 Bab 1.01 Ba 1.03 Ba 0.89 BCab 0.83 Bab 700 0.54 Cb 0.72 Ca 0.71 Ca 0.68 Cab 0.74 BCa 1 000 0.47 Cb 0.61 Ca 0.57 Da 0.54 Cab 0.61 Ca ρ (Al3+)/(mg·L−1) 根长/cm root length pH 3.5 pH 4.5 pH 5.5 pH 6.5 pH 7.5 0 2.33 Ad 3.07 Ac 3.49 Aab 4.18 Aa 3.59 Aab 100 1.25 Bd 2.65 ABc 3.74 Aab 4.00 Aa 3.90 Aa 300 0.92 BCd 1.29 Cc 3.88 Aab 4.02 Aa 3.01 ABb 500 0.92 BCd 1.28 Cc 2.09 Bbc 3.95 ABa 2.79 Bb 700 0.58 Dcd 0.72 Dc 1.18 Cbc 2.84 Ca 1.72 Cb 1 000 0.48 Dbc 0.59 Db 0.68 Db 1.00 Da 0.53 Db 2.3 酸、铝胁迫对幼苗生理特性的影响
由表4可知:不同酸胁迫下,随着Al3+质量浓度的上升,幼苗丙二醛含量均不同程度增加。pH 3.5和4.5处理下,丙二醛含量明显高于其他处理组。丙二醛含量在pH 3.5、Al3+700~1 000 mg/L处理时处于最高水平,这表明在强酸高铝胁迫下,幼苗细胞膜受到破坏较大。在pH 6.5、Al3+质量浓度0~300 mg/L处理时,幼苗丙二醛含量最低,说明楚雄南苜蓿幼苗在微酸环境和低质量浓度Al3+胁迫下依旧生长良好。
表 4 酸、铝胁迫对幼苗生理特性的影响Table 4. Effects of acid and aluminum stress on the physiological characteristics of seedlingsρ(Al3+)/(mg·L−1) 丙二醛含量/(nmol·g−1) MDA content pH 3.5 pH 4.5 pH 5.5 pH 6.5 pH 7.5 0 29.48 Ca 25.91 Ca 24.25 Bab 19.42 Bb 20.27 Bb 100 34.28 BCa 29.97 Bab 23.26 BCb 18.66 Bc 20.70 Bbc 300 36.60 Ba 27.54 Bab 21.89 Cb 19.49 Bc 24.73 Bb 500 40.59 Ba 31.57 Bb 30.54 ABb 28.30 ABb 26.07 ABc 700 43.07 ABa 37.04 Aab 36.56 Aab 32.59 Ab 29.37 Abc 1 000 50.42 Aa 42.13 Ab 36.50 Abc 32.93 Ac 30.36 Ac ρ(Al3+)/(mg·L−1) POD活性/(U·g−1·min−1) POD activity pH 3.5 pH 4.5 pH 5.5 pH 6.5 pH 7.5 0 78.45 Abc 80.22 Abc 96.00 Aa 90.00 Aab 85.67 Ab 100 75.55 Ab 76.57 Ab 91.56 ABa 92.78 Aa 74.22 Bb 300 76.44 Ab 73.33 ABb 88.67 ABa 80.44 Bab 76.45 ABb 500 71.11 ABb 67.11 Bbc 81.56 Ba 76.00 Bab 67.11 Bbc 700 68.89 Bab 60.22 Cb 73.11 Ca 70.89 BCa 58.11 Cb 1 000 60.78 Bb 60.89 Cb 70.22 Ca 62.44 Cab 57.11 Cbc ρ(Al3+)/(mg·L−1) SOD活性/ (U·g−1) SOD activity pH 3.5 pH 4.5 pH 5.5 pH 6.5 pH 7.5 0 487.53 Bb 495.71 ABb 557.87 Ba 579.14 BCa 512.06 Aab 100 491.37 Bb 496.28 ABb 588.28 ABa 593.58 Ba 487.32 ABb 300 533.33 ABbc 574.23 Ab 605.11 Ab 687.12 Aa 482.21 ABc 500 601.84 Ab 552.96 Abc 620.04 Ab 719.84 Aa 505.11 Ac 700 550.92 ABa 474.44 BCb 427.20 Cbc 584.50 Ba 464.21 Bb 1 000 462.58 BCab 479.14 BCab 374.03 CDc 514.40 Ca 365.85 Cc 在pH 3.5、4.5和7.5处理下,无论Al3+质量浓度怎么变化,楚雄南苜蓿幼苗的POD活性均小于pH 5.5和pH 6.5。在pH 7.5、Al3+为1 000 mg/L时,POD活性最低;在pH 5.5、pH 6.5,Al3+为0~100 mg/L时,POD活性最高。这意味着强酸弱碱条件下,较高质量浓度Al3+(>700 mg/L)对POD活性影响较大,在微酸条件下,低质量浓度Al3+(<300 mg/L)对POD活性影响较小。
SOD活性的大小反映了幼苗对酸、铝胁迫的适应能力。从表4中可见:在不同酸处理下,Al3+质量浓度越高,幼苗SOD活性先上升后下降,均在Al3+质量浓度为500 mg/L时达到最高值之后迅速下降,这可能是铝胁迫超过了其承受范围而导致SOD酶活性下降。其中,在pH 6.5、Al3+质量浓度500 mg/L时SOD活性最高,pH 7.5、Al3+质量浓度1 000 mg/L时SOD活性最低。
3. 讨论
土壤pH值对植物的生长[9]和养分的获取[10-11]影响非常大,每种植物对pH的适应范围是不同的。本研究发现,单一酸胁迫下,楚雄南苜蓿种子的发芽率、发芽势等都随着pH值的降低而降低。在强酸性(pH 3.5)环境下,楚雄南苜蓿幼苗根长、茎长等显著低于其他pH处理,其中,弱酸条件下各生长指标整体良好,可以理解为弱酸对种子发芽以及幼苗生长表现出一定的促进作用。这与李靖[12]、杨丹娜等[13]和李剑峰等[14]研究结果一致,但是楚雄南苜蓿耐酸性更强一些。在pH 6.5时,南苜蓿根长和茎长均达到最大值,之后随着pH值的下降迅速下降,尤其是根长,这说明根生长受酸度影响较大。
酸性土壤中植物生长受到抑制和铝毒害有直接关系,铝毒害已成为酸性土壤中植物生长受限的主要因素[15-16],但是不同植物对铝毒害的耐受能力不同。本研究发现:随着Al3+质量浓度的升高,楚雄南苜蓿发芽率、发芽势、根长和茎长均呈下降趋势,生长明显受到限制。Al3+质量浓度为0~300 mg/L是楚雄南苜蓿的最适生长区,当Al3+质量浓度大于700 mg/L时,不适合其生长,这与宫家珺等[17]的研究结果相似。同时,根长对铝离子的反应最为敏感,这与目前大部分研究结果[18-22]相同。与其他酸性红壤区常见作物[23-26]不同的是,楚雄南苜蓿能够在Al3+质量浓度为700 mg/L的环境下生存并且保持一定的生活力,说明其具有非常强的耐酸铝毒能力,在酸性土壤分布区有巨大的应用前景,为其他豆科牧草的栽培提供参考。但是楚雄南苜蓿作为云南省地方品种,其解除铝胁迫的生理及分子机制还有待进一步研究。
本研究发现:酸、铝共同胁迫比单一胁迫对楚雄南苜蓿芽苗的生长抑制作用明显。单一酸胁迫下,pH 3.5时,幼苗根长、茎长与其他pH处理之间差异显著;单一铝胁迫下,当Al3+质量浓度为700 mg/L时,其各项生长指标与其他铝胁迫处理之间差异显著;而在酸、铝共同胁迫下,当pH<4.5,Al3+质量浓度大于500 mg/L时,楚雄南苜蓿的发芽率、发芽势、根长和茎长等生长指标均表现出明显的下降,其中根长对酸、铝胁迫更为敏感,在Al3+质量浓度大于300 mg/L时即受到明显抑制,可见低pH值加剧了铝毒害的发生,这在紫花苜蓿[13, 27]、玉米[28]和荞麦[29]等酸铝胁迫研究中也观察到类似的结果。
逆境下,丙二醛是植物膜脂过氧化的主要产物,受迫害程度越大,含量越高[30];超氧化物歧化酶(SOD)能消除生物体在各种环境胁迫下产生的有害物,它的作用占90%以上[31];过氧化物酶(POD)随着胁迫程度的增强,其活性越大[32]。本试验中,MDA含量随着酸或铝的胁迫程度增强而增加,SOD活性随酸或铝的胁迫程度增强呈先增加后减少的趋势,这可能是铝胁迫超过了其承受范围而导致SOD酶活性下降。POD活性在酸、铝胁迫中变化不显著,这说明楚雄南苜蓿幼苗在强酸或高质量浓度铝胁迫下可能通过维持较高的过氧化物保护酶来抵御伤害。在本试验中,虽然在pH 3.5、500 mg/L Al3+处理时,SOD、POD活性均达到最高,但与其他处理间的差异不一致。有关植物在逆境条件下生理指标变化的研究已经有许多报道,结果不尽相同,这可能与不同植物的抗逆能力、体内保护酶系统的活力和抗氧化物质含量、毒害程度、外界环境影响等因子的不同有关。
4. 结论
(1)酸胁迫下,楚雄南苜蓿幼苗生长受到限制,且根的生长受影响较大,并且随着酸性的增强抑制作用明显增强。在pH 5.5处理下,各类指标表现较好,明显优于其他处理,说明楚雄南苜蓿在微酸性环境下生长良好。
(2)楚雄南苜蓿在Al3+质量浓度0~500 mg/L之间可以正常生长,当Al3+质量浓度达到700 mg/L时,其生长受到明显抑制,且幼苗根长对Al3+质量浓度的变化更为敏感。
(3)酸铝共同胁迫对楚雄南苜蓿种子萌发以及幼苗的生长影响大于单一胁迫,在pH低于4.5,Al3+质量浓度高于500 mg/L,楚雄南苜蓿幼苗的生长受到明显的抑制。
-
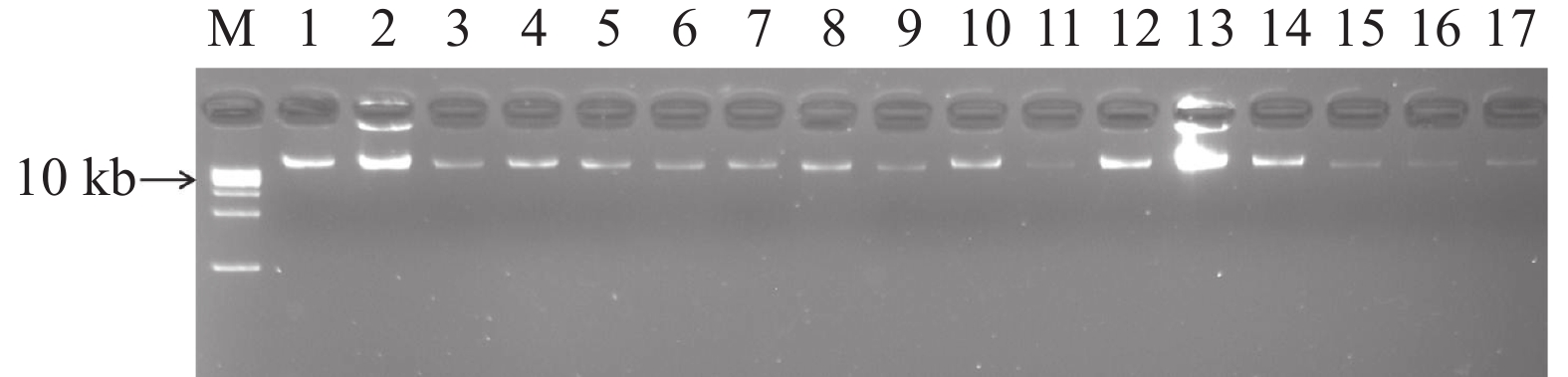
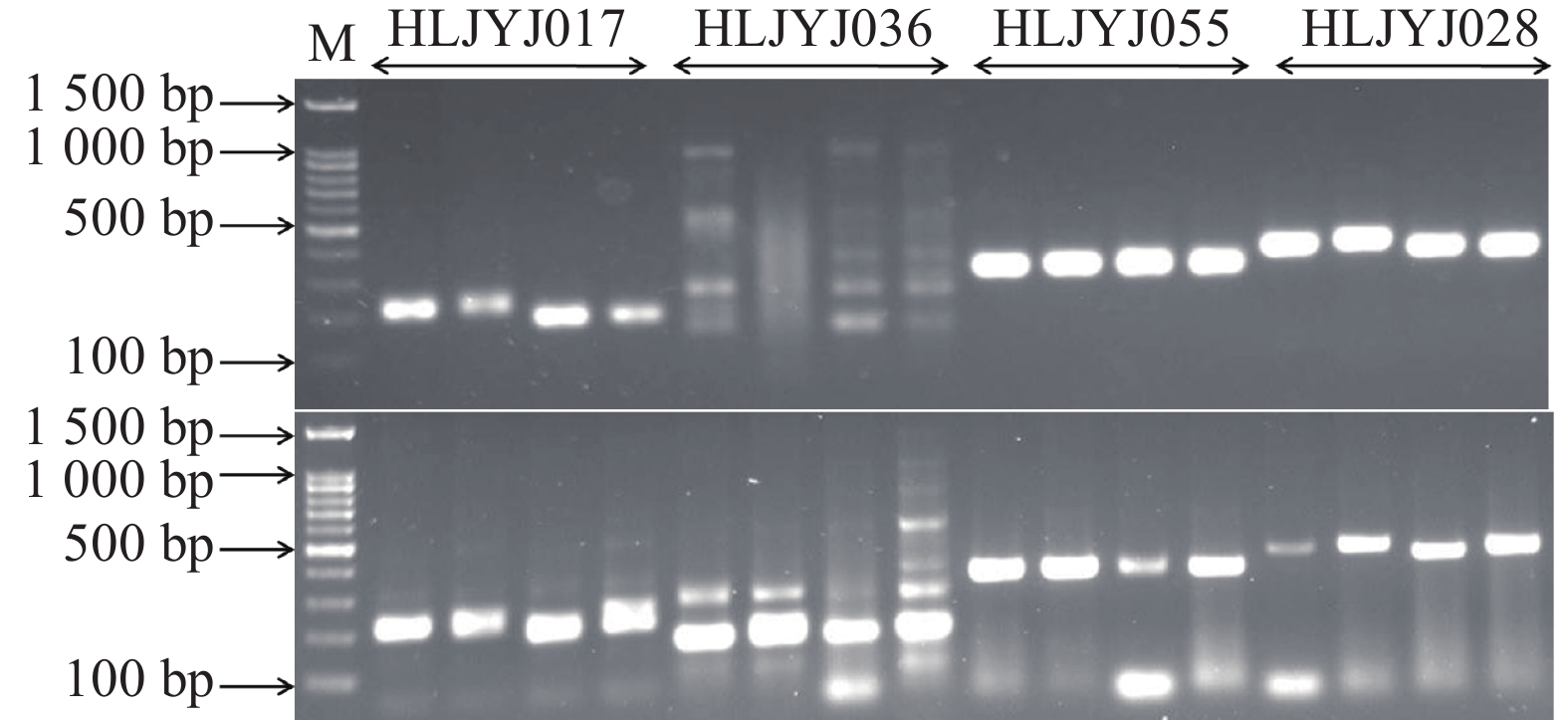
图 4 不同模板的PCR产物电泳图谱
注:M. DNA相对分子质量标准;A与D. 基因组DNA稀释5 000倍作为PCR模板;B与E. 连接产物稀释1 000倍作为PCR模板;C与F. 扩增的基因组DNA稀释50倍作为PCR模板。
Figure 4. Electrophoresis pattern of PCR products using different templates
Note: M. Marker; A and D. PCR template is the genomic DNA diluted 5 000 times; B and E. PCR template is the ligated product diluted 1 000 times; C and F. PCR template was the amplified genomic DNA diluted 50 times.
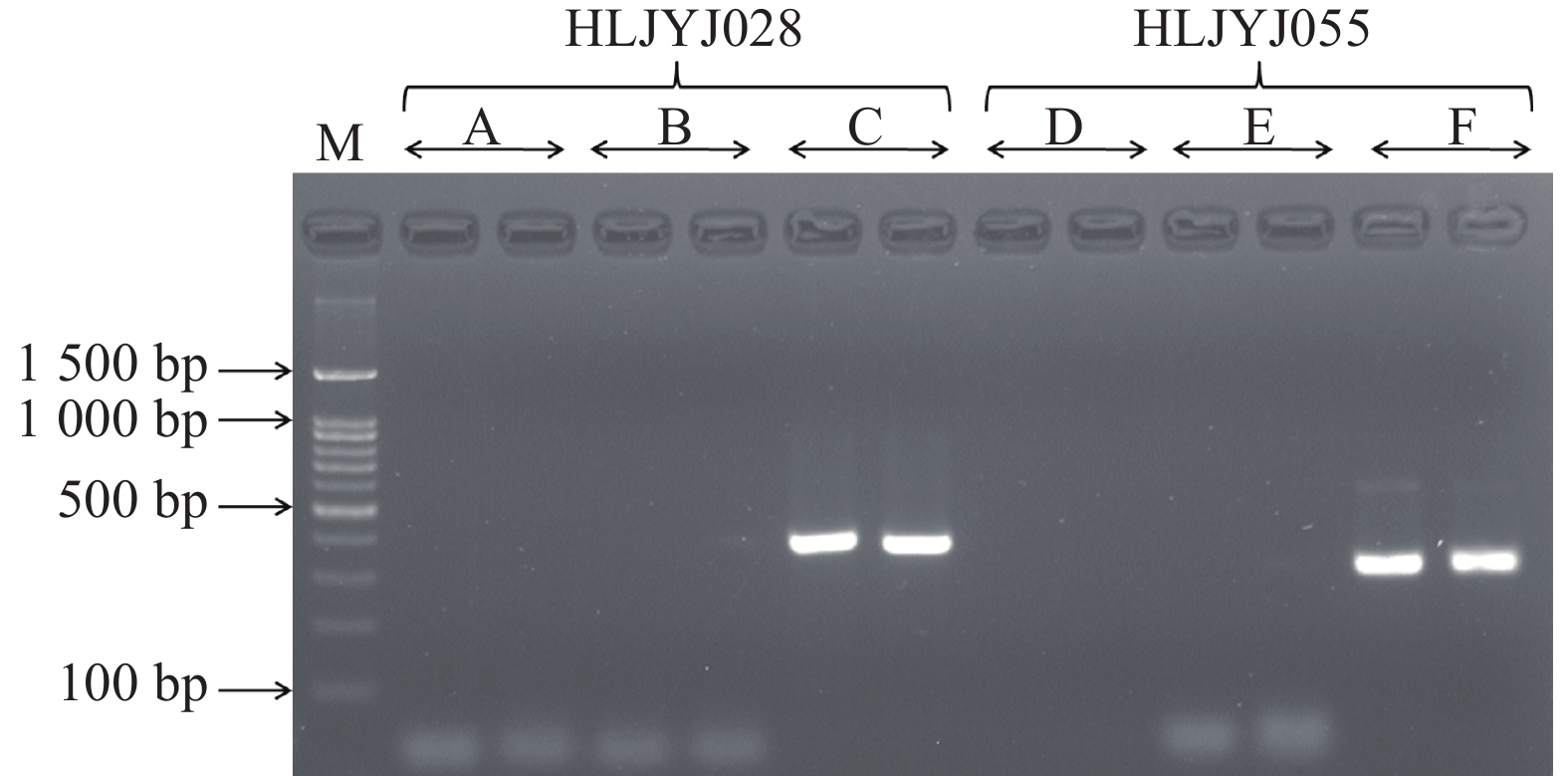
图 5 使用4尾初孵仔鱼原始基因组DNA (下)与扩增的基因组DNA (上)作为PCR模板扩增4个SSR位点的电泳图谱
注:M. DNA相对分子质量标准;HLJYJ017、HLJY036、HLJYJ055和HLJYJ028为4个SSR位点。
Figure 5. Electrophoresis patterns of PCR products of 4 microsatellite loci by original genomic DNA (below) and amplified genomic DNA (above) of four individuals
Note: M. Marker; HLJYJ017, HLJY036, HLJYJ055 and HLJYJ028 are four microsatellite loci.
表 1 基因组DNA扩增使用的接头及引物
Table 1 Sequences of adaptors and primers for genomic DNA amplification
名称
name序列(5′→3′)
sequences产物长度/bp
length基序
motif退火温度/℃
TmGenBank登录号
accession No.TaqⅠadaptor 1 5′-GACGATGAGTCCTGAG-3′ — — — — TaqⅠadaptor 2 5′-CGCTCAGGACTCAT-3′ — — — — TaqⅠ-primer 5′-GATGAGTCCTGAGCGA-3′ — — 56 — HLJY036 F: CTTATCCTGTATAGCTCGTC
R: TCATCCCGTATAGACCAC146~205 (GA)10(GT)18 50 DQ403243 HLJY012 F: GCTTGTTTTGCTGCTCAAGA
R: ATATGACTGGGCCACAGAGG155~175 (TG)35 52 DQ378981 HLJYJ017 F: CAAGAAAATTGGCACAGGATG
R: ACCCTTGACCTGTGGACCAT224~307 (ATAG)15 60 FJ827512 HLJYJ055 F: CCCTGACACACTGTCTGACC
R: TGAGCCTTTAACTCAGCATCC193~353 (GATA)13(AGAC)6 58 FJ827533 HLJYJ028 F:GCTGCTTTTAGGAAAACTAGCTG
R: TTTCCTCCACCAACAAAACT268~393 (ATCT)21(TCTG)20 58 FJ827516 -
[1] TELENIUS H, CARTER N P, BEBB C E, et al. Degenerate oligonucleotide-primed PCR: general amplification of target DNA by a single degenerate primer[J]. Genomics, 1992, 13(3): 718. DOI: 10.1016/0888-7543(92)90147-K.
[2] CHEUNG V G, NELSON S F. Whole genome amplification using a degenerate oligonucleotide primer allows hundreds of genotypes to be performed on less than one nanogram of genomic DNA[J]. Proceedings of the National Academy of Sciences, 1996, 93(25): 14676. DOI: 10.1073/pnas.93.25.14676.
[3] KITTLER R, STONEKING M, KAYSER M. A whole genome amplification method to generate long fragments from low quantities of genomic DNA[J]. Analytical Biochemistry, 2002, 300(2): 237. DOI: 10.1006/abio.2001.5460.
[4] ZHANG L, CUI X, SCHMITT K, et al. Whole genome amplification from a single cell: implications for genetic analysis[J]. Proceedings of the National Academy of Sciences, 1992, 89(13): 5847. DOI: 10.1073/pnas.89.13.5847.
[5] DIETMAIER W, HARTMANN A, WALLINGER S, et al. Multiple mutation analyses in single tumor cells with improved whole genome amplification[J]. The American Journal of Patbology, 1999, 154(1): 83. DOI: 10.1016/s0002-9440(10)65254-6.
[6] TANABE C, AOYAGI K, SAKIYAMA T, et al. Evolution of a whole-genome amplification method based on adaptor-ligation PCR of randomly sheared genomic DNA[J]. Genes, Chromosomes and Cancer, 2003, 38(2): 168. DOI: 10.1002/(ISSN)1098-2264.
[7] DEAN F B, NELSON J R, GIESLER T L, et al. Rapid amplification of plasmid and phage DNA using Phi29 DNA polymerase and multiply-primed rolling circle amplification[J]. Genome Research, 2001, 11(6): 1095. DOI: 10.1101/gr.180501.
[8] VINCENT M, XU Y, KONG H M. Helicase-dependent isothermal DNA amplification[J]. EMBO Reports, 2004, 5(8): 795. DOI: 10.1038/sj.embor.7400200.
[9] LI Y, KIM H J, ZHENG C Y, et al. Primase-based whole genome amplification[J]. Nucleic Acids Research, 2008, 36(13): e79. DOI: 10.1093/nar/gkn377.
[10] LIU C L, SCHREIBER S L, BERNSTEIN B E. Development and validation of a T7 based linear amplification for genomic DNA[J]. BMC Genomics, 2003, 4: 19. DOI: 10.1186/1471-2164-4-19.
[11] JIA Z Y, SUN X W, LIANG L Q, et al. Isolation and characterization of microsatellite markers from Fangzheng silver crucian carp, Carassius auratus gibelio (Bloch), and cross-amplification in the closely related species crucian carp, Carassius auratus auratus (Linnaeus)[J]. Molecular Ecology Notes, 2006, 6(4): 1141. DOI: 10.1111/j.1471-8286.2006.01464.X.
[12] ZHENG X H, LU C Y, ZHAO Y Y, et al. A set of polymorphic trinucleotide and tetranucleotide microsatellite markers for silver crucian carp (Carassius auratus gibelio) and cross-amplification in crucian carp[J]. Biochemical Genetics, 2010, 48(7/8): 624. DOI: 10.1007/s10528-010-9344-1.
[13] OETTING W S, LEE H K, FLANDERS D J, et al. Linkage analysis with multiplexed short tandem repeat polymorphisms using infrared fluorescence and M13 tailed primers[J]. Genomics, 1995, 30(3): 450. DOI: 10.1006/geno.1995.1264.
[14] LI N, WANG L, WANG H, et al. The performance of whole genome amplification methods and next-generation sequencing for pre-implantation genetic diagnosis of chromosomal abnormalities[J]. Journal of Genetics and Genomics, 2015, 42(4): 151. DOI: 10.1016/j.jgg.2015.03.001.
[15] HEINMÖLLER E, LIU Q, SUN Y, et al. Toward efficient analysis of mutations in single cells from ethanol-fixed, paraffin-embedded, and immunohistochemically stained tissues[J]. Laboratory Investigation, 2002, 82(4): 443. DOI: 10.1038/labinvest.3780437.
[16] PAEZ J G, LIN M, BEROUKHIM R, et al. Genome coverage and sequence fidelity of 29 polymerased-based multiple-strand displacement whole-genome amplification[J]. Nucleic Acids Research, 2004, 32(9): e71. DOI: 10.1093/nar/gnh069.
[17] NELSON J R, CAI Y C, GIESLER T L, et al. Templiphi, ϕ29 DNA polymerase based rolling circle amplification of templates for DNA sequencing[J]. Biotechniques Suppl, 2002, 32(6s): 44. DOI: 10.2144/02321bm04.
[18] HUGHES S, ARNESON N, DONE S, et al. The use of whole genome amplification in the study of human disease[J]. Progress in Biophysics and Molecular Biology, 2005, 88(1): 173. DOI: 10.1016/j.pbiomolbio.2004.01.007.
[19] ZANE L, BARGELLONI L, PATARNELLO T. Strategies for microsatellite isolation: a review[J]. Molecular Ecology, 2002, 11(1): 1. DOI: 10.1046/j.0962-1083.2001.01418.x.
[20] LUCITO R, NAKIMURA M, WEST J A, et al. Genetic analysis using genomic representations[J]. Proceedings of the National Academy of Sciences, 1998, 95(8): 4487. DOI: 10.1073/pnas.95.8.4487.
[21] KLEIN C A, SCHMIDT-KITTLER O, SCHARDT J A, et al. Comparative genomic hybridization, loss of heterozygosity, and DNA sequence analysis of single cells[J]. Proceedings of the National Academy of Sciences, 1999, 96(8): 4494. DOI: 10.1073/pnas.96.8.4494.
-
期刊类型引用(7)
1. 黄媚,何斌,吴庆标. 铝胁迫对秃杉种子萌发与根尖生理特征的影响. 广西林业科学. 2024(03): 352-358 .  百度学术
百度学术
2. 褚志云,袁素霞,祁惠,张盖天,任志雨,刘春. 铝离子对八仙花生长发育影响的研究进展. 分子植物育种. 2023(13): 4438-4443 .  百度学术
百度学术
3. 黎梅杰,段正山,姜华,周凯,罗富成,段新慧,韩博. 铝胁迫下楚雄南苜蓿的生理响应. 云南农业大学学报(自然科学). 2023(04): 615-620 .  百度学术
百度学术
4. 卫丹丹,王丙全,刘美君,万瑞霞,关怡雪,刘忠艳. 镉铝胁迫对藜麦种子萌发和光合特性的影响. 云南农业大学学报(自然科学). 2023(04): 673-683 .  百度学术
百度学术
5. 周万海,胡连清,刘雯雯,蔡意凤,冯瑞章,魏琴,赵鑫,陈露. NO对铝胁迫下绛三叶种子萌发及幼苗生长的影响. 宜宾学院学报. 2023(12): 44-49+79 .  百度学术
百度学术
6. 黄凯,张红宇,张菡倩,李元,祖艳群,陈建军. 植物应答铝毒的分子机制研究进展. 生物技术通报. 2021(03): 125-135 .  百度学术
百度学术
7. 姜娜,任健,罗富成,许文花,孙文君,张冉,曹力,毕玉芬,马向丽. 铝胁迫对不同耐铝基因型紫花苜蓿根尖及细胞壁氧化酶活性的影响. 中国草地学报. 2020(06): 15-22 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载: